
【题目】现有部分短周期元素的性质或原子结构如表:
元素编号 | 元素性质或原子结构 |
A | 有三个电子层,K,M层电子数之和等于L层电子数 |
B | 短周期中金属性最强 |
C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
D | 元素最高正价是+7价 |
(1)用化学用语回答下列问题:
①A元素在周期表中的位置;
②C单质分子的电子式;
③D的原子结构示意图;
④电子式表示A和B元素组成的化合物的形成过程: .
(2)元素D与元素A相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是(填选项序号).
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A最高价含氧酸的酸性弱于D最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)X是由A,B,C,D四种元素中的某种元素组成的单质,能经图所示的过程转化为(其他条件略去). ![]()
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,无现象,然后滴加适量H2O2溶液,有白色沉淀生成,则该白色沉淀为 , 试写出Y与H2O2溶液反应的化学方程式:;
②若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂物质的量之比为 .
【答案】
(1)第三周期第ⅥA族;![]() ;
; ;
;![]()
(2)Cl;bde
(3)BaSO4;SO2+H2O2=H2SO4;1:2
【解析】解:A元素原子有三个电子层,K、M层电子数之和等于L层电子数,则其M层电子数=8﹣2=6,故A为硫;B在短周期中金属性最强,则B为Na;常温下C单质为双原子分子,氢化物的水溶液呈碱性,则C为氮元素;D元素最高正价是+7价,且为短周期元素,故D为Cl.
(1.)①A为S元素,原子核外有3个电子层、最外层电子数为6,处于周期表中第三周期第ⅥA族,所以答案是:第三周期第ⅥA族;②C单质为N2 , 分子中氮原子之间形成3对共用电子对,电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;③Cl原子核外电子数为17,原子结构示意图为
;③Cl原子核外电子数为17,原子结构示意图为 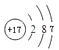 ,所以答案是:
,所以答案是:  ;④Na2S属于离子化合物,钠原子与硫原子的电子式表示硫化钠的形成过程为:
;④Na2S属于离子化合物,钠原子与硫原子的电子式表示硫化钠的形成过程为: ![]() ,所以答案是:
,所以答案是: ![]() ;
;
(2.)Cl元素非金属性比硫的强,a.常温下单质的状态属于物理性质,不能用以判断非金属性的强弱,故a错误;b.D的氢化物比A的氢化物稳定,说明D的非金属性较强,故b正确;c.一定条件下D和A的单质都能与钠反应,说明都具有氧化性,但不能说明非金属性的强弱,故c错误;d.A的最高价含氧酸酸性弱于D的最高价含氧酸,说明D的非金属性较强,故d正确;e.D单质能与A的氢化物反应生成A单质,说明D的非金属性较强,故e正确.所以答案是:Cl:bde;
(3.)X是由S、Na、N、Cl四种元素中的某种元素组成的单质,①若Y是有刺激性气味的无色气体,硫元素单质化合物性质符合,可推知X为硫、Y为SO2、Z为SO3、W为H2SO4 , SO2通入BaCl2溶液中,然后滴加适量H2O2溶液,SO2被氧化性为硫酸,发生反应:SO2+H2O2=H2SO4 , 硫酸与氯化钡反应生成硫酸钡与盐酸,白色沉淀为BaSO4 , 该反应的化学方程式为:BaCl2+SO2+H2O2=BaSO4↓+2HCl,所以答案是:BaSO4;SO2+H2O2=H2SO4;②若Z是红棕色气体,则Z为NO2 , 则X为N2、Y为NO、W为HNO3 , 则Z→W的反应为3NO2+H2O=2HNO3+NO,反应中二氧化氮是氧化剂、还原剂,起氧化剂的二氧化氮生成NO,起还原剂的二氧化氮生成硝酸,故氧化剂与还原剂物质的量之比=1:2,所以答案是:1:2.


科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族.C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子.
请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):
(1)A~F六种元素,最高价氧化物的水化物显碱性的元素在周期表中的位置是;
(2)A、C、D三种元素组成的一种常见化合物是重要的工业产品,该化合物含有的化学键为;
(3)B与F两种元素形成的一种化合物分子,各原子均达8e﹣稳定结构,用电子式表示该化合物的形成过程;
(4)E的最高价氧化物的水化物可作为铅蓄电池的电解质溶液,写出该电池放电时的正极方程式:正极 .
(5)比较E、F的非金属性强弱:EF(填大于或小于).写出可以验证该结论的一个化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学键与晶体结构说法正确的是( )
A.两种元素组成的分子中一定只有极性键
B.离子化合物的熔点一定比共价化合物的高
C.非金属元素组成的化合物一定是共价化合物
D.含有阴离子的化合物一定含有阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢键是介于范德华力和化学键之间的一种作用力,广泛存在于许多物质中.氢键的通式可表示为X﹣H…Y,其中X、Y均是非金属性较强、半径较小的原子,如F、O、N等;X、Y可以是同种原子也可以是不同种原子.
(1)用氢键的通式分别表示:冰中H2O分子间的氢键 , 氨水中H2O分子与NH3分子之间的氢键 .
(2)已知水中2个水分子之间可以发生微弱的自偶电离,电离方程式为:2H2OH3O++OH﹣ . 实验测得在液氨中2个NH3分子之间也可以微弱地电离生成含有相同电子数的离子,其电离方程式是: , 写出这两种离子的电子式、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,把一个盛有一定量甲烷和氯气的密闭玻璃容器放在光亮的地方,两种气体发生反应,下列叙述不正确的是
A.容器内压强不变 B. 容器内分子总数不变
C.容器内原子总数不变 D. 容器内发生的反应是取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列碳原子的物质的量为1 mol的是( )
A. 0.012 kg C B. 0.012 kg12C
C. 0.012 kg13C D. 0.012 kg12C和13C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来运用有机合成的方法制备出了许多具有下图所示立体结构的环状化合物,如

(1)写出上述物质Ⅱ的分子式_____________;
(2)Ⅰ、Ⅱ、Ⅲ之间的关系是_____________;
A.同素异形体 B.同系物 C.同分异构体 D.同种物质
(3)利用结构Ⅰ能解释苯的下列事实的是_____________,利用结构Ⅱ或Ⅲ不能解释苯的下列事实的是_____________
A.苯不能使酸性KMnO4溶液褪色
B.苯不能与溴水因发生化学反应而使溴水褪色
C.在一定条件下能和H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工程塑料ABS树脂的结构简式为: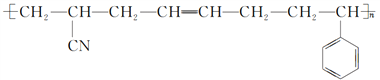 ,一种合成ABS树脂的路线如下:(A、B、S分别表示合成时的三种单体)
,一种合成ABS树脂的路线如下:(A、B、S分别表示合成时的三种单体)
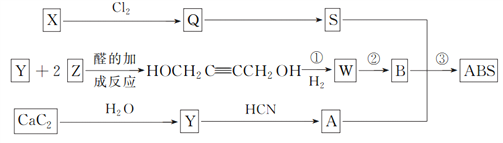
(1)写出Y和Z的结构简式:Y________,Z________。
(2)反应类型:反应②________;反应③________。
(3)事实上,工业上获得单体S是将X在高温下催化脱氢而制得的,催化剂多为Fe2O3等金属氧化物。
①试写出工业上获得S的化学方程式:______________________;
②与图示获得S相比,其优越性有_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com