
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
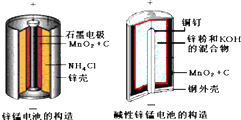
分析 (1)酸性锌锰干电池的负极为锌;
(2)正极上二氧化锰得电子发生还原反应生成MnOOH;
(3)持电流强度为0.6A,电池工作10分钟,则电量为0.6A×600s=360C,转移电子的物质的量为$\frac{360C}{96500C/mol}$=0.00373mol,以此计算消耗锌的质量、物质的量;
(4)①根据表格中的信息可知,Fe(OH)3沉淀的生成更容易,而Zn(OH)2和Fe(OH)2的沉淀同时发生.故要想除去锌中的铁杂质,应将铁转化为Fe3+,而铁和稀硫酸只能反应为Fe2+,故应加入氧化剂,据此分析;
②根据Ksp计算Zn2+开始沉淀的pH和Fe3+沉淀完全的pH,然后根据调节pH的目的是使Fe3+沉淀完全而Zn2+不沉淀来分析.
解答 解:(1)酸性锌锰干电池的负极为锌,负极反应为Zn-2e-=Zn2+,故答案为:Zn-2e-=Zn2+;
(2)在碱性锌锰原电池中,Zn易失电子作负极、二氧化锰作正极,正极上二氧化锰得电子发生还原反应,电极反应式为MnO2+e-+H2O=MnOOH+OH-.故答案为:MnO2+e-+H2O=MnOOH+OH-;
(3)持电流强度为0.6A,电池工作10分钟,则电量为0.6A×600s=360C,转移电子的物质的量为$\frac{360C}{96500C/mol}$=0.00373mol,则消耗Zn的质量为0.00373mol×$\frac{1}{2}$×65g/mol=0.12g,
故答案为:0.12;
(4)①根据表格中的信息可知,Fe(OH)3沉淀的生成更容易,而Zn(OH)2和Fe(OH)2的沉淀同时发生.故要想除去锌中的铁杂质,应将铁转化为Fe3+,而铁和稀硫酸只能反应为Fe2+,故应加入氧化剂,故可以加入绿色的氧化剂双氧水,故答案为:双氧水;
②由于调节pH的目的是使Fe3+沉淀完全而Zn2+不沉淀.而
设Zn2+开始沉淀时所需的氢氧根的浓度为c(OH-),则有:0.1mol/L×c2(OH-)=10-17,解得c(OH-)=10-8mol/L,则c(H+)=10-6mol/L,pH=6.
设Fe3+沉淀完全时所需的氢氧根的浓度为c(OH-),由于当一种离子沉淀完全时即浓度小于等于10-5mol/L时,则有:10-5mol/L×c3(OH-)=10-39,解得c(OH-)=$\root{3}{1{0}^{-34}}$mol/L≈0.5×10-11mol/L,此时pH=2.7.
故应调节pH在2.7到6之间.故答案为:2.7;6.
点评 本题考查原电池知识以及物质的分离、提纯,侧重于原电池的工作原理以及实验基本操作和注意问题,题目难度中等,有利于培养学生良好的科学素养.


科目:高中化学 来源: 题型:多选题
| A. | AlCl3 | B. | Na2CO3 | C. | Na2SO3 | D. | MgSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
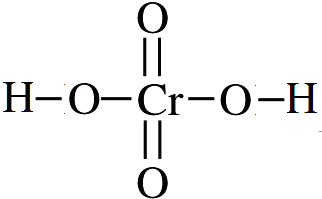 .
.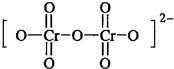
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
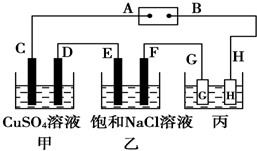 如图所示的装置,C、D、E、F都是惰性 电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答以下问题:
如图所示的装置,C、D、E、F都是惰性 电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
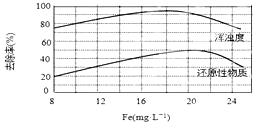
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
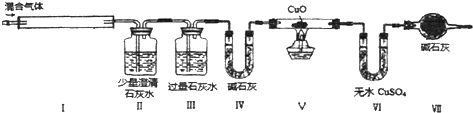
| A. | 混合气体中一定有NO2和CO | |
| B. | 混合气体中一定没有H2和NH3 | |
| C. | 混合气体中一定含有H2、NO、CO2、HCl四种气体 | |
| D. | 不能确定混合气体中是否有NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com