
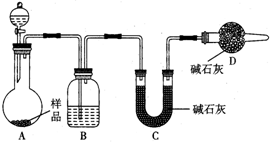
 为测定放置已久的小苏打样品中纯碱的质量分数,设计如下实验方案:
为测定放置已久的小苏打样品中纯碱的质量分数,设计如下实验方案:分析 (1)该方案原理为在加热的条件下Na2CO3能够稳定存在,而NaHCO3较易发生如下的分解反应2NaHCO3=Na2CO3+CO2↑+H2O,从而可根据其反应产生的CO2和水蒸汽H2O的量或残留的固体的量推算出小苏打样品中纯碱的质量分数,该方案根据加热后残渣的质量来求解,自然要加热至恒重,以保证NaHCO3全部分解.
(2)该方案原理为一定量混合样品与足量的稀硫酸分别发生如下反应Na2CO3+H2SO4=Na2SO4+CO2↑+H2O,
2 NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O↑,根据所产生的CO2的质量,可以分别求得样品中Na2CO3和NaHCO3的质量从而得出纯碱的质量分数.该方案关键是要获得产生的CO2的质量,自然在实验前要检查装置的气密性,要将装置中的CO2全部被碱石灰所吸收,要称量碱石灰在吸收CO2前后的质量.
①盐酸具有挥发性,会影响实验结果.D干燥管中的碱石灰吸收空气中的水蒸气、二氧化碳,防止进入C.
②实验根据C装置前后质量变化判断生成二氧化碳的质量.
③装置中容器内含有二氧化碳,不能被C中碱石灰完全吸收,导致测定结果有较大误差.
(3)该方案原理为在样品中加入BaCl2溶液,其中Na2CO3可与BaCl2发生反应Na2CO3+BaCl2=BaCO3↓+2NaCl,而NaHCO3与BaCl2则不反应.从而根擗产生的沉淀量,得出纯碱的质量分数,方案关键是测定BaCO3沉淀的质量,自然要保证沉淀完全,要正确过滤好.
①试验中判断沉淀是否完全的方法是:取上层清液少许于试管中,再滴加BaCl2溶液少许,如无白色沉淀出现,说明沉淀完全.
②在一定量样品中加入足量Ba(OH)2溶液,此时分别发生如下反应Na2CO3+Ba(OH)2=BaCO3↓+2NaOH,NaHCO3+Ba(OH)2=BaCO3↓+NaOH+H2O,均产生BaCO3沉淀,根据样品的总量和生成BaCO3沉淀的量,就可得出纯碱的质量分数.
解答 解:(1)该方案根据加热后残渣的质量来求解,要加热至恒重,以保证NaHCO3全部分解.
故答案为:保证NaHCO3全部分解;
(2)①盐酸具有挥发性,会影响实验结果,所以选择稀硫酸;D干燥管中的碱石灰吸收空气中的水蒸气、二氧化碳,防止进入C被吸收,减少误差.
故答案为:吸收空气中的水蒸气、二氧化碳,防止进入C被吸收;
②根据所产生的CO2的质量及样品质量,分别求得样品中Na2CO3和NaHCO3的质量从而得出纯碱的质量分数,所以需称量C装置前后质量变化判断生成二氧化碳的质量.
故答案为:C;
③装置A、B中容器内含有二氧化碳,不能被C中碱石灰完全吸收,导致测定结果有较大误差.
故答案为:装置A、B中容器内含有二氧化碳,不能被C中碱石灰完全吸收,导致测定结果有较大误差;
(3)①试验中判断沉淀是否完全的方法是:取上层清液少许于试管中,再滴加BaCl2溶液少许,如无白色沉淀出现,说明沉淀完全.
故答案为:将小烧杯内反应后的物质静置,取上层清液少许于试管中,向其中加入一定量的Na2SO4溶液,若溶液变浑浊则沉淀已完全;
②发生反应Na2CO3+Ba(OH)2=BaCO3↓+2NaOH,NaHCO3+Ba(OH)2=BaCO3↓+NaOH+H2O.
样品9.5g,干燥的沉淀碳酸钡质量为19.7g,物质的量为$\frac{19.7g}{197g/mol}$=0.1mol,令样品中碳酸钠的物质的量为xmol、碳酸氢钠的物质的量为ymol,
则106x+84y=9.5,
x+y=0.1,
解得x=0.05,y=0.05,
所以碳酸钠的质量为106g/mol×0.05mol=5.3g,
所以碳酸钠质量分数为$\frac{5.3g}{9.5g}$×100%=55.8%.
故答案为:55.8%.
点评 本题以实验探究“测定放置已久的小苏打样品中纯碱的质量分数”为载体,考查学生对于实验原理与装置理解评价、实验基本操作、化学计算等,难度中等,题目涉及到的小苏打和纯碱的化学知识是多方面的,构成了一道多角度的探究题.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 有7个周期,18个族 | |
| B. | 第IA族元素也称为碱金属元素 | |
| C. | 元素种类最多的族为第IIIB族 | |
| D. | 第七周期若排满,最多可排50种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
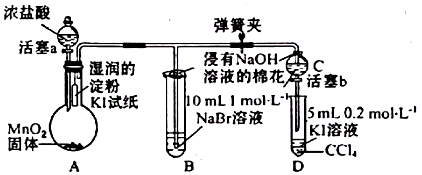
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. ,它能与双氧水在酸性条件下反应,生成两种无毒气体,其离子方程式为2CN-+5H2O2+2H+═N2↑+2CO2↑+6H2O.
,它能与双氧水在酸性条件下反应,生成两种无毒气体,其离子方程式为2CN-+5H2O2+2H+═N2↑+2CO2↑+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铝是一种高硬度高熔沸点化合物 | |
| B. | 铝是活泼金属,其合金抗腐蚀能力差 | |
| C. | 常温下铝能与氧气反应 | |
| D. | 氢氧化铝能中和胃酸,可用于制胃药 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com