
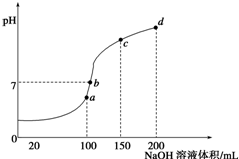
 室温时,向100mL 0.1mol/L NH4HSO4溶液中滴加0.1mol/L NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示.
室温时,向100mL 0.1mol/L NH4HSO4溶液中滴加0.1mol/L NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示.分析 (1)NH4HSO4溶液与NaOH反应时H+先反应、NH4+后反应,向100mL 0.1mol/L NH4HSO4溶液中滴加0.1mol/L NaOH溶液时,当V(NaOH)=100mL时,H+恰好完全反应生成水;当V(NaOH)=200mL时,NH4+恰好完全反应生成NH3.H2O;
(2)a点V(NaOH)=100mL,二者恰好反应生成(NH4)2SO4、Na2SO4,c点V(NaOH)=150mL时,溶液中氢离子完全反应、有一半的铵根离子参加反应,所以溶液中溶质为(NH4)2SO4、Na2SO4、NH3.H2O,d点V(NaOH)=200mL时,二者恰好完全反应生成Na2SO4、NH3.H2O,根据物料守恒判断各物质的物质的量;
(3)酸或碱抑制水电离,含有弱离子的盐促进水电离,据此判断水电离程度大小.
解答 解:(1)NH4HSO4溶液与NaOH反应时H+先反应、NH4+后反应,向100mL 0.1mol/L NH4HSO4溶液中滴加0.1mol/L NaOH溶液时,当V(NaOH)=100mL时,H+恰好完全反应生成水;当V(NaOH)=200mL时,NH4+恰好完全反应生成NH3.H2O,
所以o-a段离子方程式为H++OH-=H2O、a-d段离子方程式为NH4++OH-=NH3.H2O,
答:o-a段离子方程式为:H++OH-=H2O;a-d段离子方程式为NH4++OH-=NH3.H2O;
(2)a点V(NaOH)=100mL,二者恰好反应生成 (NH4)2SO4、Na2SO4,根据N原子、Na原子守恒得n[(NH4)2SO4]=$\frac{1}{2}$n(NH4HSO4)=$\frac{1}{2}$×0.1mol/L×0.1L=0.005mol,n(Na2SO4)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×0.1mol/L×0.1L=0.005mol;
c点V(NaOH)=150mL时,溶液中氢离子完全反应、有一半的铵根离子参加反应,所以溶液中溶质为(NH4)2SO4、Na2SO4、NH3.H2O,
n(NH3.H2O)=2n[(NH4)2SO4]=0.005mol,n(Na2SO4)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×0.1mol/L×0.15L=
=0.0075mol,
d点V(NaOH)=200mL时,二者恰好完全反应生成Na2SO4、NH3.H2O,根据Na原子守恒得n(Na2SO4)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×0.1mol/L×0.2L=0.01mol,n(NH3.H2O)=2n[(NH4)2SO4]=2×0.1mol/L×0.1L=0.02mol,
答:a点溶质为 (NH4)2SO4、Na2SO4,n[(NH4)2SO4]=n(Na2SO4)=0.005mol;
c点溶质为(NH4)2SO4、Na2SO4、NH3.H2O,
n(NH3.H2O)=2n[(NH4)2SO4]=0.005mol,n[(NH4)2SO4]=0.0025mol,
n(Na2SO4)=0.0075mol,
d点溶质为Na2SO4、NH3.H2O,n(Na2SO4)=0.01mol,n(NH3.H2O)=0.02mol;
(3)酸或碱抑制水电离,含有弱离子的盐促进水电离,
a点溶质为 (NH4)2SO4、Na2SO4;
b点溶质为 (NH4)2SO4、Na2SO4、NH3.H2O,但一水合氨浓度小于c点;
c点溶质为(NH4)2SO4、Na2SO4、NH3.H2O,但一水合氨浓度小于d点,
d点溶质为Na2SO4、NH3.H2O,
溶液中酸浓度或碱浓度越大,抑制水电离程度越大,所以a点促进水电离、bcd点抑制水电离,且抑制水电离程度b<c<d,
则水的电离程度最大点是a点、抑制水电离程度最大点是d点,即水电离程度最小点是d,
答:a点促进水电离、bcd点抑制水电离;水电离程度最大点是a点、水电离程度最小点是d点.
点评 本题考查盐和碱混合溶液定性判断及水电离程度大小比较,为高频考点,侧重考查分析判断及计算能力,明确各点溶液中溶质成分及其物质的量大小是解本题关键,注意原子守恒的应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取是常用的有机物提纯方法 | |
| B. | 燃烧法是研究确定有机物成分的有效方法之一 | |
| C. | 对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 | |
| D. | 核磁共振氢谱通常用于分析有机物的相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Q、R、X、Y、Z是原子序数依次增大的前四周期元素,Q的一种单质是天然存在的最硬的物质,X原子的核外电子有八种运动状态,Y元素的离子半径是第三周期中最小的,Z是第四周期中未成对电子最多的原子.
Q、R、X、Y、Z是原子序数依次增大的前四周期元素,Q的一种单质是天然存在的最硬的物质,X原子的核外电子有八种运动状态,Y元素的离子半径是第三周期中最小的,Z是第四周期中未成对电子最多的原子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2是氧化剂,NaOH是还原剂 | |
| B. | 被氧化的Cl原子与被还原的Cl原子的个数比为1:5 | |
| C. | 氧化剂与还原剂的物质的量的比为1:2 | |
| D. | 每生成1mol的NaClO3转移6mol的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.08 | 0.08 |
| A. | 从反应开始直至60s和80s时,二氧化氮的平均反应速率是相等的 | |
| B. | 80s后将容器的体积缩小为1L,平衡向正反应方向移动,气体颜色变浅 | |
| C. | n1的范围是0.28<n1<0.33 | |
| D. | 升高温度,既能加快反应速率,也能提高N2O4的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g Na2O2与足量H2O反应,电子转移1.204×1023 NA个 | |
| B. | 16 g O2和O3的混合气体中,含O原子 NA个 | |
| C. | 1.12 L氯气中含有0.1 NA个氯原子 | |
| D. | 标准状况下,2.24 L水中含有0.1 NA个水分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com