
 �������繤ҵ���õķ�չ���˿ڵľ�����ȫ����Դ���ż�������������Խ��Խ���ص����⣬��ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2������ȫ������ձ����ӣ�
�������繤ҵ���õķ�չ���˿ڵľ�����ȫ����Դ���ż�������������Խ��Խ���ص����⣬��ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2������ȫ������ձ����ӣ�| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ��/ ��mol•L-1�� | 0.44 | 0.6 | 0.6 |
| ��ѧ�� | N��N | F-F | N-F |
| ����/kJ•mol-1 | 941.7 | 154.8 | 283.0 |
���� ��1��C�ܽ�CuO�е�ͭ�û�������
��2�����ݸ�˹���ɿ�֪����Ӧ��ֻ��ʼ̬����̬�йأ����뷴Ӧ��;���أ�
��3������Ũ���̺�ƽ�ⳣ���Ƚ��жϷ�Ӧ���еķ���
��4����Ӧ�ȵ��ڷ�Ӧ����ܼ��ܼ�ȥ��������ܼ��ܣ�
��5����2H2O��g��=2H2��g��+O2��g����H1��
��H2��g��+Cl2��g��=2HCl��g����H2 ��
��2Cl2��g��+2H2O��g��=4HCl��g��+O2��g����H3��
��Ӧ��=��+2���ڣ��ɸ�˹���ɼ��㣻
��6����6Ag��s��+O3��g���T3Ag2O��s������H=-235.8kJ•mol-1��
��2Ag2O��s���T4Ag��s��+O2��g������H=+62.2kJ•mol-1��
���ݸ�˹���ɿ�֪���2+���3�ɵõ���2O3��g���T3O2��g�����Դ˼��㷴Ӧ�ȣ�
��� �⣺��1��C�ܽ�CuO�е�ͭ�û�����������ͭ��CO���ʻ�ѧ����ʽΪC+CuO$\frac{\underline{\;����\;}}{\;}$Cu+CO�����ʴ�Ϊ��C+CuO$\frac{\underline{\;����\;}}{\;}$Cu+CO����
��2�����ݸ�˹���ɿ�֪����Ӧ��ֻ��ʼ̬����̬�йأ����뷴Ӧ��;���أ�ͨ���۲��֪;�����;�����ǵ�Ч�ģ�;�����;���������úȼ�����ĵ�������ȣ���;������������ֻ�ж�����̼������;����ų�����������;����ų���������
�ʴ�Ϊ�����ڣ�
��3���÷�Ӧ��Ũ����=$\frac{c��CH{\;}_{3}OCH{\;}_{3}��•c��H{\;}_{2}O��}{c{\;}^{2}��CH{\;}_{3}OH��}$=$\frac{0.6��0.6}{0.44{\;}^{2}}$=1.86��400���ʷ�Ӧ������Ӧ������У�����Ӧ���ʴ����淴Ӧ���ʣ��ʴ�Ϊ������
��4����Ϊ��Ӧ�ȵ��ڷ�Ӧ����ܼ��ܼ�ȥ��������ܼ��ܣ����Է�ӦN2��g��+3F2��g��=2NF3��g����H=��941.7+3��154.8-283.0��6��KJ•mol-1=-291.9KJ•mol-1���ʴ�Ϊ��-291.9KJ•mol-1��
��5����2H2O��g��=2H2��g��+O2��g����H1��
��H2��g��+Cl2��g��=2HCl��g����H2 ��
��2Cl2��g��+2H2O��g��=4HCl��g��+O2��g����H3��
��Ӧ��=��+2���ڣ��ɸ�˹���ɿ�֪����H3=��H1+2��H2����ѡ��A��
��6����6Ag��s��+O3��g���T3Ag2O��s������H=-235.8kJ•mol-1��
��2Ag2O��s���T4Ag��s��+O2��g������H=+62.2kJ•mol-1��
���ݸ�˹���ɿ�֪���2+���3�ɵõ���2O3��g���T3O2��g������Ӧ�ȡ�H=��-235.8kJ•mol-1����2+��+62.2kJ•mol-1����3=-285kJ/mol��
�ʴ�Ϊ��2O3��g���T3O2��g����H=-285kJ/mol��
���� ���⿼����ۺϣ��漰�Ȼ�ѧ��Ӧ����ʽ����˹���ɵ�Ӧ�ã����ط�Ӧԭ���Ŀ��飬ע��֪ʶ��Ǩ��Ӧ�ã���Ŀ�Ѷ��еȣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
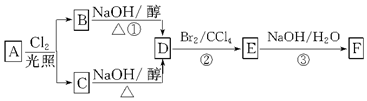
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
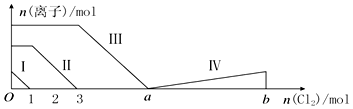
| A�� | �߶��ʾBr-�ı仯��� | |
| B�� | �߶���ʾIO3-�ı仯���������IO3-������5moL�� | |
| C�� | a=6 | |
| D�� | ԭ��Һ��n��FeI2����n��FeBr2��=3��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����C2H4 ��g��+H2O��g��?C2H5OH��g������һ�������´ﵽƽ��״̬ʱ����ϵ����ѹǿΪP������C2H4��g����H2O��g����C2H5OH��g����Ϊ2 mol�����÷�ѹ��ʾ��ƽ�ⳣ��Kp=$\frac{3}{P}$ | |
| B�� | ���º�ѹ�£���һ�ݻ��ɱ�������У�N2��g��+3H2��g��?2NH3��g���ﵽƽ��״̬ʱ��N2��H2��NH3��1mol������ʱ�ٳ���3mol N2����ƽ�������ƶ� | |
| C�� | ���º�ѹ�£���һ�ݻ��ɱ�������У���Ӧ2A��g��+B��g��?2C��g���ﵽƽ��ʱ��A��B�� C�����ʵ����ֱ�Ϊ4mol��2mol��4mol������ʱA��B��C������1 mol��ƽ�������ƶ� | |
| D�� | ����һ�������µ�ijһ���淴Ӧ����ƽ��Ũ�ȱ�ʾ��ƽ�ⳣ������ƽ���ѹ��ʾ��ƽ�ⳣ��������ֵ��ͬ����������ͬ����ֻ���¶��й� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CaCO3$\frac{\underline{\;����\;}}{\;}$CaO+CO2�� | B�� | Na2O+H2O=2NaOH | ||
| C�� | Na2CO3+2HCl=2NaCl+H2O+CO2�� | D�� | 4HNO3��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$4NO2��+O2��+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
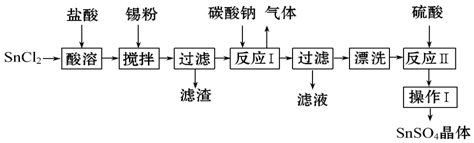
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ˮ�еĸ�բ�����ӵ�Դ�ĸ��� | B�� | ������������Ϳ�� | ||
| C�� | ��ˮ������Ϳ�߷���Ĥ | D�� | ���¸ֹ�����п�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ij����С����Ƶ�ʵ������ȡ����������װ����ͼ��ʾ��A��ʢ��ŨH2SO4��B��ʢ���Ҵ�����ˮ�����ƣ�D��ʢ�б���̼������Һ��
ij����С����Ƶ�ʵ������ȡ����������װ����ͼ��ʾ��A��ʢ��ŨH2SO4��B��ʢ���Ҵ�����ˮ�����ƣ�D��ʢ�б���̼������Һ��| �Լ� | ���� | �Ҵ� | ���� | �������� |
| �е㣨�棩 | 34.7 | 78.5 | 118 | 77.1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com