
【题目】在一定温度下,将气体X和气体Y 各0.16mol 充入 10L 恒容密闭容器中,恒容器闭容器中,发生反应X(g)+Y(g) ![]() 2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如表,下列说法正确的是
2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如表,下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)mol | 0.12 | 0.11. | 0.10 | 0.10 |
A.反应前 2min 的平均速率 v(Z)=2.0×10-3mol·L-1min-1
B.其他条件不变,向平衡体系中再充入0.16mol 气体 X,与原平衡相比,达到新平衡时,气体 Y 的转化率增大,X 的体积分数增大,Z 的体积分数减少
C.其他条件不变,降低温度,反应达到新平衡前 v (逆)>v(正)
D.保持其他条件不变,起始时向溶液中充入0.32mol气体X 和0.32mol 气体 Y,到达平衡时,n(Z)<0.24mol
【答案】B
【解析】
A.2min内Y物质的量变化为0.16mol-0.12mol=0.04mol,所以Y的反应速率v(Y)=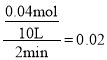 mol·L-1·min-1,速率之比等于化学计量系数之比,所以v(Z)=2 v(Y)=2×0.02 mol·L-1·min-1=0.04 mol·L-1·min-1,故A错误;
mol·L-1·min-1,速率之比等于化学计量系数之比,所以v(Z)=2 v(Y)=2×0.02 mol·L-1·min-1=0.04 mol·L-1·min-1,故A错误;
B.其他条件不变,向平衡体系中再充入0.16mol 气体 X,平衡正向移动,Y的转化率增大,因为加入X,所以X的体积分数增大,因为总体积增大,虽然Z的物质的量也有所增大,但总体积增大更大些,所以Z的体积分数减少,故B正确;
C.该反应为放热反应,当其他条件不变,降低温度时,平衡会向正反应方向移动,所以反应达到新平衡前 v(正)>v (逆),故C错误;
D.保持其他条件不变,起始时向容器中充入0.32mol气体X 和0.32mol 气体 Y,根据等效平衡原理,相当于在原来平衡的基础上增大压强,又因为反应前后气体体积不变,所以平衡不移动,达到平衡时,n(Z)=0.24mol,故D错误;
综上所述,答案为B。


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z 为原子序数依次增大的短周期主族元素。元素W 分别与元素 X、Y、Z 结合形成质子数相同的甲、乙、丙三种分子。反应②是工业制硝酸的重要反应,乙与丙的混合物不能用玻璃瓶盛装。上述物质有如图所示的转化关系:
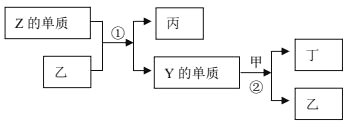
下列说法错误的是
A.甲是易液化气体,常用作致冷剂
B.可以用甲在一定条件下消除丁对环境的污染
C.甲、丙分子可以直接化合生成离子化合物
D.丁是一种红棕色气体,是大气主要污染物之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2SO2(g)+O2(g)=2SO3(g)△H=-196.6kJ/mol,在温度、容积均相同的 3 个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mol O2、2mol SO2 | 2mol SO3 | 1mol SO3 |
SO3的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) |
|
|
|
反应物转化率 | α1 | α2 | α3 |
下列说法不正确的是
A.c1>2c3B.a+b=196.6
C.p2>2p3D.α1+α3>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如右图所示。活化氧可以快速氧化 SO2。下列说法不正确的是
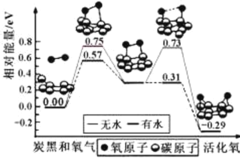
A.每活化一个氧分子放出0.29eV能量
B.水可使氧分子活化反应的活化能降低0.42eV
C.氧分子的活化是O-O的断裂与C-O键的生成过程
D.炭黑颗粒是大气中SO2转化为SO3的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钨广泛用于冶金、机械、建筑、电子等领域。以黑钨精矿为原料冶炼钨的流程如图所示:
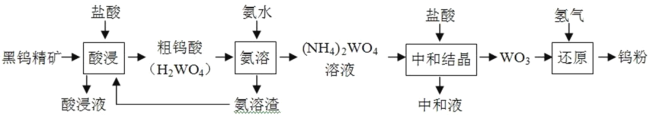
请回答下列问题。
(1)“酸浸液”中含有 Fe3+、Fe2+等金属离子,检验其中的 Fe2+常使用铁氰化钾溶液,反应的离子方程式 为_____。
(2)“氨溶”时需加热,但应控制温度不超过 70℃的原因为_____。
(3)“中和结晶”时(NH4)2WO4 与盐酸反应生成 WO3 的化学方程式为_____,所得“中和 液”的主要溶质的电子式为_____。
(4)流程图中设计将“氨溶渣”返回“酸浸”过程的目的为__________。
(5)钨钛合金在工业中应用广泛, NH4Fe(SO4)2 滴定法可测定合金中钛的含量:称取 w g 钨钛合金,用 HNO3-HF混合液溶解,用 NaOH 溶液沉淀并分离钛元素后加盐酸溶解,用金属铝将 Ti4+还原为 Ti3+,向溶液中加几滴 KSCN 作指示剂,用 c mol/L 的 NH4Fe(SO4)2 标准溶液滴定至溶液显红色,消耗标准溶液的体积为 V mL。
①滴定时发生反应的离子方程式是_____;
②样品中钛的含量为_____%(用含 w、c、V 的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生的实验报告中,描述合理的是( )
A.用量筒量取25.20mL的稀盐酸
B.用pH试纸测得NaClO溶液的pH约为11
C.将CuCl2溶液蒸发浓缩、降温结晶、过滤得到氯化铜晶体
D.用25mL酸式滴定管量取出15.00mLKMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铅蓄电池进行电絮凝净水是水净化方面的一项研究课题,其工作原理如图所示,下列叙述正确的是( )

A.Y的电极反应:PbO2+2e-+SO42-+4H+=PbSO4+2H2O
B.铅蓄电池工作时H+向X极移动
C.电解池的总反应本质为电解水
D.每消耗103.5gPb,理论上电解池阴极上有11.2LH2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)![]() 的核外电子排布式:________________________ 。
的核外电子排布式:________________________ 。
(2)![]() 的价电子排布式:________________________ 。
的价电子排布式:________________________ 。
(3)![]() 的电子式:________________________ 。
的电子式:________________________ 。
(4)![]() 的价电子轨道表示式: ________________________ 。
的价电子轨道表示式: ________________________ 。
(5)![]() 的原子结构示意图: ________________________ 。
的原子结构示意图: ________________________ 。
(6)第四周期中最外层只有1个电子的所有基态原子的简化电子排布式:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com