
【题目】在温度压强不变时,1mol NO2高温分解,生成NO和O2,达到平衡时容器内气体的物质的量变为1.2mol,这时NO2的转化率为
A. 10%B. 20%C. 40%D. 50%
科目:高中化学 来源: 题型:
【题目】合理的利用吸收工业产生的废气CO2、NO2、SO2 等可以减少污染,变废为宝。
(1)用CO2可以生产燃料甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=﹣akJmol﹣1;
2H2(g)+O2(g)═2H2O(l)△H=﹣b kJmol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:_______________________。
(2)光气(COCl2)是重要化工原料,常用于聚酯类材料的生产,工业通过Cl2(g)+CO(g)COCl2(g)△H < 0制备。图为实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:

①0~6min内,反应的平均速率v(Cl2)=___________;
②该反应第一次达平衡时的平衡常数为___________,10min改变的条件是_____________。
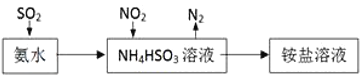
(3)利用氨水可以将SO2和NO2吸收,原理如图所示:NO2被吸收的离子方程式是________________________________。
(4)对于2NO(g)+2CO(g)![]() N2(g)+2CO2(g),于1 L的恒容密闭容器中进行反应。下列能说明该反应已经达到平衡状态的是________(填字母代号)。
N2(g)+2CO2(g),于1 L的恒容密闭容器中进行反应。下列能说明该反应已经达到平衡状态的是________(填字母代号)。
A.c(CO)=c(CO2) B.容器中混合气体的密度不变
C.2v(N2)正=v(NO)逆 D.容器中混合气体的平均摩尔质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】云阳龙缸云端廊桥曾被詟为“世界第一悬挑玻璃景观廊桥”,所用钢化玻璃因其优良的性能广泛应用于日常生活,但由于制作玻璃时里面含有极少量硫化镍,使得钢化玻璃在极限条件下的使用受到限制.
(1)基态硫原子价层电子的轨道表达式(电子排布图)为____________,基态镍原子中核外电子占据最高能层的符号为_____________.
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为___________晶体,Ni(CO)4空间构型与甲烷相同,中心原子的杂化轨道类型为___________,写出与配体互为等电子体的阴离子__________________________________________________________(任写一种).
(3)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱 > (填化学式)______,理由是_______________________________________________________________.
(4)H2S的键角__________(填“大于”“小于””等于”)H2O的键角,请从电负性的角度说明理由___________________________________________________.
(5)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的空隙中,已知Ni2+半径为69nm,O2-半径为140nm,阿伏伽德罗常数为NA,NiO晶体的密度为_________g/cm3(只列出计算式).

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下硫酸亚铁发生反应2FeSO4 ![]() Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀是
Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀是
A. BaS B. BaSO3 C. BaSO4 D. BaSO3和BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中进行反应:3H2(g) + N2(g)![]() 2NH3(g),经过一段时间后,NH3物质的量增加0.8 mol,这段时间内用N2表示的平均反应速率为0.01 mol·L-1·s-1。则这段时间为
2NH3(g),经过一段时间后,NH3物质的量增加0.8 mol,这段时间内用N2表示的平均反应速率为0.01 mol·L-1·s-1。则这段时间为
A. 10 sB. 20 sC. 30 sD. 40 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向30mL某浓度氢氧化钠溶液中通入CO2气体后得溶液N,因CO2通入量不同,溶液N的组成也不同。若向N溶液中逐滴加入0.1mol/L盐酸,产生的气体体积V(CO2)与加入的盐酸体积V[HCl(aq)]的关系有如图所示两种情况(不计CO2的溶解),则曲线Y表明N中的溶质为_______________________, 原NaOH溶液的物质的量浓度为________;由曲线X、Y可知,两次实验通入CO2的体积之比为X:Y=___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学研究领域,经常需要对一些物质进行性质的确定。如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下:
①准确称量m g金属镁(已除去表面氧化膜),用铜网包住放入干净的试管中;
②按图示组装好装置,然后在关闭活塞的分液漏斗中装入一定体积2 mol/L的盐酸;
③调整右边玻璃管(带均匀刻度值),让U型管(下端黑色部分是橡胶管)两端液面在同一水平面,读出右边玻璃管的液面刻度值为V1mL ;
④打开分液漏斗活塞,让一定量的盐酸进入试管中后立即关闭活塞;
⑤当镁条反应完后, ,读出右边玻璃管的液面刻 度为V2 mL。

请回答下列问题:
(1)写出你认为步骤⑤中空格应进行的操作_______________________________。
(2)若V1,V2均是折算为标况下的值,则镁的相对原子质量Ar(Mg)的实验测定表达式为Ar(Mg)=_______________,你认为此表达式求出的值是否准确?__________________(填‘是’或‘不’),主要问题为__________________________________(若回答‘是’则此空不填)。
(3)步骤①中,为什么要用铜网包住镁条?________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的转换在生产、生活中具有重要的应用。
Ⅰ.CO2的低碳转型对抵御气候变化具有重要意义。
(1)海洋是地球上碳元素的最大“吸收池”。
①溶于海水中的CO2主要以四种无机碳形式存在,除CO2、H2CO3两种分子外,还有两种离子的化学式为____________。
②在海洋碳循环中,可通过下图所示的途径固碳。写出钙化作用的离子方程式:_____________。

(2)将CO2与金属钠组合设计成Na-CO2电池,很容易实现可逆的充、放电反应,该电池反应为4Na+3CO2 ![]() 2Na2CO3+C。放电时,在正极得电子的物质为______;充电时,阳极的反应式为_____。
2Na2CO3+C。放电时,在正极得电子的物质为______;充电时,阳极的反应式为_____。
Ⅱ.环境中的有害物质常通过转化为CO2来降低污染。
(3)TiO2是一种性能优良的半导体光催化剂,能有效地将有机污染物转化为CO2等小分子物质。下图为在TiO2的催化下,O3降解CH3CHO的示意图,则该反应的化学方程式为____。

(4)用新型钛基纳米PbO2作电极可将苯、酚类等降解为CO2 和H2O。该电极可通过下面过程制备:将钛基板用丙酮浸泡后再用水冲洗,在钛板上镀上一层铝膜。用它做阳极在草酸溶液中电解,一段时间后,铝被氧化为氧化铝并同时形成孔洞。再用Pb(NO3)2溶液处理得纳米PbO2,除去多余的氧化铝,获得钛基纳米PbO2电极。
①用丙酮浸泡的目的是______。
②电解时,电流强度和基板孔洞深度随时间变化如图所示,氧化的终点电流突然增加的原因是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中加入4molSO2和2molO2,发生下列反应2SO2(g)+O2(g)![]() 2SO3(g),
2SO3(g),
(1)若充分反应后能否得到4molSO3?为什么?__________________________
(2)若经5s后,剩下的SO2为2.5mol,则用O2表示的反应速率是多少?5s末SO3浓度是多少?
______________、__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com