
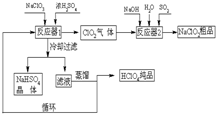
 工业上生产高氯酸(沸点:90°C)时还同时生产了亚氯酸钠,其工艺流程如下:
工业上生产高氯酸(沸点:90°C)时还同时生产了亚氯酸钠,其工艺流程如下:

科目:高中化学 来源: 题型:
 工业上生产高氯酸(沸点:90°C)时还同时生产了亚氯酸钠,其工艺流程如下:
工业上生产高氯酸(沸点:90°C)时还同时生产了亚氯酸钠,其工艺流程如下:查看答案和解析>>
科目:高中化学 来源: 题型:
工业上生产高氯酸(沸点:90oC)时还同时生产了亚氯酸钠,其工艺流程如下:

(1)冷却过滤的目的 。
(2)通入反应器2的SO2作用是 ;反应器2中发生反应的离子方程式为 。
(3)循环使用的物质是 。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是 。
(5)通过电解NaClO3水溶液的方法也可以制备NaClO4,进而可以制备HClO4,写出阳极的电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)工业上生产高氯酸(沸点:90oC)时还同时生产了亚氯酸钠,其工艺流程如下:
(1)冷却过滤的目的是降低NaHSO4的 并分离出NaHSO4晶体。
(2)反应器2中发生反应的离子方程式为 。SO2的作用是作 剂。
(3)循环使用的物质是 。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是 。
(5)工业上用铂作阳极、铜或银作阴极电解盐酸也可制得高氯酸,在阳极区可得到20%的高氯酸。写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上生产高氯酸(沸点:90oC)时还同时生产了亚氯酸钠,其工艺流程如下:
(1)冷却过滤的目的 。
(2)通入反应器2的SO2作用是 ;反应器2中发生反应的离子方程式为 。
(3)循环使用的物质是 。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是 。
(5)通过电解NaClO3水溶液的方法也可以制备NaClO4,进而可以制备HClO4,写出阳极的电极反应式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省韶关市高三调研测试理综化学试卷(解析版) 题型:填空题
工业上生产高氯酸(沸点:90°C)时还同时生产了亚氯酸钠,其工艺流程如下:
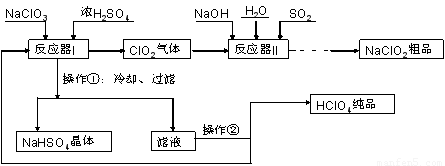
(1)实验室进行过滤操作的常用玻璃仪器有???????????? 。
(2)反应器I中的温度最佳为???????? (填序号);操作②的名称为????????? 。
A. 0°C ;????????? B. 20°C ;??????? C. 80°C ;????????? D. 120°C??
(3)反应器II中发生反应的离子方程式为?????????????? 。
(4)加快反应器II中反应速率的措施有?????????????? (写出一种措施即可)等。从反应器II中获得NaClO2?? 粗品的实验操作依次是???????? (填序号,下同),进一步提纯的操作名称为???????? 。
A.过滤? B.重结晶? C.蒸馏? D.蒸发浓缩? E.蒸干灼烧? F.冷却结晶? G.萃取分液
(5)上述流程中可循环使用的物质为???????? ,副产品除NaClO2、NaHSO4外还有???????? (填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com