
元素的单质及其化合物有着广泛的用途.请根据元素周期表中第三周期元素相关知识回答下列问题.
完成下列填空:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是b.
a.原子半径和简单离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层中p亚层电子数相同的元素名称是硫,磷元素原子最外层电子排布的轨道表示式是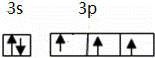 .
.
(3)已知:
化合物 MgO Al2O3 MgCl2 AlCl3
类型 离子化合物 离子化合物 离子化合物 共价化合物
熔点/℃ 2800 2050 714 191
工业制镁时,电解MgCl2而不电解MgO的原因是 ;
制铝时,电解Al2O3而不电解AlCl3的原因是 .
(4)晶体硅(熔点1410℃)是良好的半导体材料.由粗硅制纯硅过程如下:
Si(粗)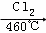 SiCl4
SiCl4 SiCl4(纯)
SiCl4(纯)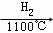 Si(纯)
Si(纯)
在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式: .
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式: .
考点: 同一周期内元素性质的递变规律与原子结构的关系.
专题: 元素周期律与元素周期表专题;元素及其化合物.
分析: (1)a.同一周期,原子半径随着原子序数增大而减小,简单离子半径先减小后增大再减小;
b.同一周期元素,元素的金属性减弱,非金属性增强;
c.元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强;
d.同一周期元素,其单质的熔点先增大后减小;
(2)原子最外层电子数与次外层中p亚层电子数相同的元素名称是硫,磷元素原子最外层有5个电子,分别位于3s、3p轨道;
(3)氧化镁熔点远远大于氯化镁,电解MgO冶炼Mg浪费能源;
氯化铝是共价化合物,熔融状态下不导电;
(4)在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,
1120gSi的物质的量=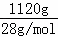 =40mol,生成40mol纯硅需要吸收akJ热量,则生成1mol纯硅放出的热量为0.025kJ热量,据此书写其热化学方程式;
=40mol,生成40mol纯硅需要吸收akJ热量,则生成1mol纯硅放出的热量为0.025kJ热量,据此书写其热化学方程式;
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,根据元素守恒知,该盐为KCl,另一种盐的阴阳离子个数比为1:1,根据化合价升降相等配平即可.
解答: 解:(1)a.同一周期,原子半径随着原子序数增大而减小,简单离子半径先减小后增大再减小,故错误;
b.同一周期元素,元素的金属性减弱,非金属性增强,即金属性减弱、非金属性增强,故正确;
c.元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,所以其最高价氧化物的水化物碱性减弱、酸性增强,故错误;
d.同一周期元素,其单质的熔点先增大后减小,Si的熔点最高,故错误;
(2)原子最外层电子数与次外层中p亚层电子数相同的元素名称是硫,磷元素原子最外层有5个电子,分别位于3s、3p轨道,其轨道表示式为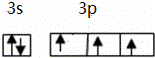 ,
,
故答案为:硫; ;
;
(3)氧化镁熔点远远大于氯化镁,电解MgO冶炼Mg浪费能源,所以用熔融态氯化镁冶炼镁;
氯化铝是共价化合物,熔融状态下以分子存在,所以不导电,则用熔融氧化铝冶炼Al,
故答案为:MgO的熔点高,熔融时消耗更多能量,增加生产成本;氯化铝是共价化合物,熔融态氯化铝难导电;
(4)在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,
1120gSi的物质的量=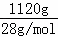 =40mol,生成40mol纯硅需要吸收akJ热量,则生成1mol纯硅吸收的热量为0.025kJ热量,其热化学方程式为2H2(g)+SiCl4(g)
=40mol,生成40mol纯硅需要吸收akJ热量,则生成1mol纯硅吸收的热量为0.025kJ热量,其热化学方程式为2H2(g)+SiCl4(g)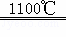 Si(s)+4HCl(g)△H=+0.025akJ•mol﹣1,故答案为:2H2(g)+SiCl4(g)
Si(s)+4HCl(g)△H=+0.025akJ•mol﹣1,故答案为:2H2(g)+SiCl4(g)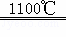 Si(s)+4HCl(g)△H=+0.025akJ•mol﹣1;
Si(s)+4HCl(g)△H=+0.025akJ•mol﹣1;
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1,则该无氧酸为KCl,KCl中氯元素化合价为﹣1,说明氯酸钾中氯元素化合价降低,则另一种含氧酸盐中氯元素化合价会升高,由于氯酸钾中氯元素化合价为+5,则氯元素化合价升高只能被氧化成高氯酸钾,根据氧化还原反应中化合价升降相等配平该反应为:4KClO3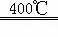 KCl+3KClO4,
KCl+3KClO4,
故答案为:4KClO3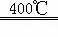 KCl+3KClO4.
KCl+3KClO4.
点评: 本题以第三周期为例考查同一周期元素性质递变规律,涉及反应方程式的书写、热化学方程式的书写、金属的冶炼、原子结构等知识点,综合性较强,会根据金属活泼性强弱确定金属冶炼方法,知道冶炼铝不用氯化铝的原因,题目难度中等.


科目:高中化学 来源: 题型:
下列各组离子既能与镁粉反应,又能大量共存,且其溶液为无色溶液的是( )
A. Ca2+、Cl﹣、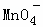 、Na+ B. K+、Cl﹣、
、Na+ B. K+、Cl﹣、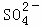 、H+
、H+
C. OH﹣、Na+、Al3+、I﹣ D. H+、Cl﹣、Ba2+、Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中发生下列反应aA(g)⇌cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是()
A. 平衡向正反应方向移动 B. a<c+d
C. D的体积分数变大 D. A的转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
从香荚兰豆中提取的一种芳香化合物,其分子式为C8H8O3,与FeCl3溶液会呈现特征颜色,能发生银镜反应.该化合物可能的结构简式是()
A. 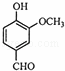 B.
B. 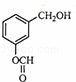 C.
C. 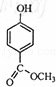 D.
D. 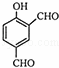
查看答案和解析>>
科目:高中化学 来源: 题型:
1,6﹣已二酸(G)是合成尼龙的主要原料之一,可用含六个碳原子的有机化合物氧化制备.如图为A通过氧化反应制备G的反应过程(可能的反应中间物质为B、C、D、E和F):
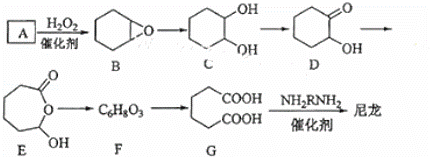
回答下列问题:
(1)化合物A中含碳87.8%,其余为氢,A的化学名称为 .
(2)B到C的反应类型为 .
(3)F的结构简式为 .
(4)在上述中间物质中,核磁共振氢谱出峰最多的是DE,最少的是F.(填化合物代号)
(5)由G合成尼龙的化学方程式为 .
(6)由A通过两步反应制备1,3﹣环已二烯的合成路 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下某密闭容器中,可逆反应A(g)+3B(g)⇌2C(g)+2D(s)达到平衡,下列描述一定正确的是( )
①C的生成速率与C的分解速率相等 ②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再变化 ④反应物的转化率不再变化
⑤混合气体的压强不再变化 ⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成 3amolB ⑧A、B、C、D的分子数之比为1:3:2:2.
|
| A. | ①②③④⑤⑥⑦ | B. | ①③④⑤⑥⑦ | C. | ①③④⑥⑦ | D. | ①③⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表归纳是学习化学的一种常用科学方法,某同学做出了如图所示的归纳,下列对应正确的是( )
选项-X-Y-Z
A-混合物-溶液-胶体
B-酸-强酸-硫酸
C-纯净物-无机物-甲烷
D-化合物-碱性氧化物-酸性氧化物
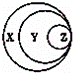
-A.-A-B.-B-C.-C-D.-D
查看答案和解析>>
科目:高中化学 来源: 题型:
在20g密度为d g/cm3的硝酸钙溶液里含1g Ca2+,则硝酸根离子的物质的量浓度是( )
|
| A. |
| B. |
|
|
| C. | 1.25d mol•L﹣1 | D. | 2.5d mol•L﹣1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com