
【题目】研究CO2与CH4反应使之转化为CO和H2,对减缓燃料危机和减少温室效应具有重要的意义。工业上CO2与CH4发生反应I:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1
在反应过程中还发生反应Ⅱ:H2(g)+CO2(g)=H2O(g)+CO(g)△H2=+41kJ/mol
(l)已知部分化学键的键能数据如下表所示:
化学键 | C—H | H—H | C=O |
|
键能(kJ/mol) | 413 | 436 | 803 | 1076 |
则△Hl =____kJ/mol,反应Ⅰ在一定条件下能够自发进行的原因是____,该反应工业生产适宜的温度和压强为____(填标号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)工业上将CH4与CO2按物质的量1:1投料制取CO2和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。
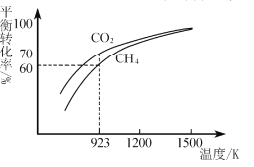
①923K时CO2的平衡转化率大于CH4的原因是________________________
②计算923K时反应II的化学平衡常数K=______(计算结果保留小数点后两位)。
③1200K以上CO2和CH4的平衡转化率趋于相等的原因可能是____。
(3)工业上CH4和CO2反应时通常会掺入O2发生反应
III: CH4+2O2=CO2+2H2O,掺人O2可消除反应产生的积碳和减小反应器的热负荷(单位时间内维持反应发生所需供给的热量),O2的进气量与反应的热负荷的关系如图所示。
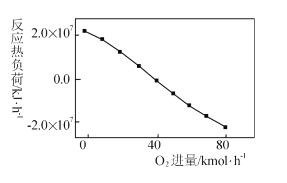
①随着O2进入量的增加,热负荷下降的原因是 ____。
②掺人O2可使CH4的平衡转化率____(填“增大”、“减小”或“不变”。下同),CO2的平衡转化率________
【答案】+234 △S>0 B CH4和CO2按1:1投料发生反应I时转化率相等,CO2还发生反应II,所以平衡转化率大于CH4 0.39 1200K以上时以反应I为主,二者转化率趋于相等(或1200K以上时反应I的正向进行程度远大于反应II)(或1200K以上时反应I的平衡常数远大于反应II) 反应III放热,给反应体系提供能量,使热负荷降低 增大 减小
【解析】
(l)已知部分化学键的键能,通过反应物的总键能减去生成物的总键能可以计算
△Hl,从焓变和熵变综合判断反应Ⅰ自发反应的原因,从平衡移动角度来判断反应条件;
(2)工业上将CH4与CO2按物质的量1:1投料,发生反应Ⅰ、II,则
①923K时CO2的平衡转化率大于CH4的原因从二者实际参加的反应来讨论;
②从图、及题干中提供的数据结合反应Ⅰ、II,用三段式按定义计算923K时反应II的化学平衡常数K;
③1200K以上CO2和CH4的平衡转化率趋于相等的原因还是从实际参加的反应来讨论;
(3)工业上CH4和CO2反应时通常会掺入O2,则发生反应 III: CH4+2O2=CO2+2H2O;
①按热负荷的定义——单位时间内维持反应发生所需供给的热量以及O2的进气量与反应III放出的热量关系,据此解题;
②发生反应 III: CH4+2O2=CO2+2H2O,分析甲烷、二氧化碳的物质的量及消耗量,分析CH4的平衡转化率和CO2的平衡转化率受到的影响;
![]()
(l)已知部分化学键的键能,焓变等于反应物的总键能减去生成物的总键能,则△Hl=![]() ;
;
答案为:+234;
反应I:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1![]() ,△S>0,因此△S>0是反应Ⅰ自发反应的原因,该反应是吸热、气体分子总数增大的反应,因此,选择高温低压的条件;
,△S>0,因此△S>0是反应Ⅰ自发反应的原因,该反应是吸热、气体分子总数增大的反应,因此,选择高温低压的条件;
答案为:△S>0; B;
(2)①923K时反应Ⅰ中CH4和CO2的平衡转化率是一样的,但是,二氧化碳还参加反应II,因此其平衡转化率大于CH4;
答案为:CH4和CO2按1:1投料发生反应I时转化率相等,CO2还发生反应II,所以平衡转化率大于CH4;
②CH4和CO2按1:1投料,设投料时的物质的量浓度为1mol/L,由图知CH4和CO2的转化率为60%、70%,则发生反应I时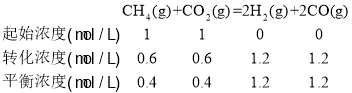
发生反应II: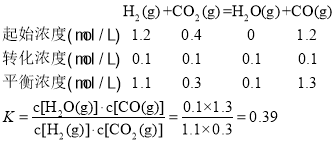 ;
;
答案为:0.39;
③反应I中CO2和CH4的平衡转化率相等,1200K以上CO2和CH4的平衡转化率趋于相等则意味着该条件对反应I更有利,以反应I为主;
答案为:1200K以上时以反应I为主,二者转化率趋于相等(或1200K以上时反应I的正向进行程度远大于反应II)(或1200K以上时反应I的平衡常数远大于反应II);
(3)工业上CH4和CO2反应时通常会掺入O2,则发生反应 III: CH4+2O2=CO2+2H2O,
①反应III是放热反应,给反应体系提供能量,通入氧气越多反应中放出的热量越多,则热负荷值越小;
答案为:反应III放热,给反应体系提供能量,使热负荷降低;
②发生反应 III: CH4+2O2=CO2+2H2O,促进甲烷消耗,则CH4的平衡转化率增大;
答案为:增大;
发生反应 III: CH4+2O2=CO2+2H2O不利于反应I,减少了二氧化碳的消耗量,又使二氧化碳浓度增大,因此二氧化碳的平衡转化率下降;
答案为:减小。


科目:高中化学 来源: 题型:
【题目】二硫化钼(MoS2)被誉为“固体润滑剂之王”,利用低品质的辉钼矿(含MoS2、SiO2以及 CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如图:
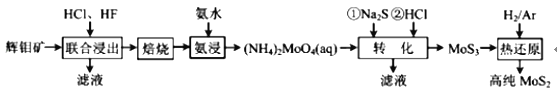
回答下列问题:
(1)(NH4)2MoO4中Mo的化合价为_____。
(2)“联合浸出”中HF除去的杂质化学式为_____,“焙烧”时MoS2转化为MoO3的化学方程式为_____。
(3)“转化”中加入Na2S后,(NH4)2MoO4转化为(NH4)2MoS4,写出(NH4)2MoS4与盐酸生成MoS3的离子方程式_____。
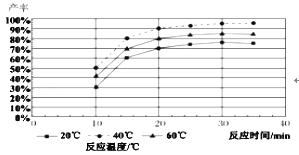
(4)由图分析产生MoS3沉淀的流程中应选择的最优温度和时间是_____,利用化学平衡原理分析低于或高于最优温度时,MoS3的产率均下降的原因_____。
(5)高纯MoS2中存在极微量非整比晶体杂质MoS2.8,则该杂质中Mo4+与Mo6+的物质的量之比为_____。
(6)已知Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8,不纯的 Na2MoO4溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去SO42-(溶液体积变化忽略),则当SO42-完全沉淀时,溶液中c(MoO42-)<_____mol/L(保留2位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是以环戊烷为原料制备环戊二烯的合成路线,下列说法正确的是( )
![]()
A.A的结构简式为![]()
B.反应④的反应试剂和反应条件是浓H2SO4加热
C.①②③的反应类型分别为取代、消去、加成
D.环戊二烯可发生加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
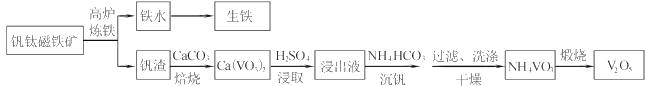
【题目】工业上以钒钛磁铁矿为原料,在炼铁的同时还可以制备钒的最高价氧化物V2O5,其主要流程如下:
已知:①VO3-+2H+![]() VO2++H2O
VO2++H2O
②NH4VO3微溶于冷水,易溶于热水,不溶于乙醇
(1)高炉炼铁应用的冶炼方法是____(填标号)
A.热分解法 B.热还原法 C.电解法
(2)钒渣中的V2O3在焙烧时转化为Ca(VO3)2,写出该反应的化学方程式__。
(3)Ca(VO3)2难溶于水但能溶于稀硫酸,试用平衡移动原理分析其原因_,浸出液中含钒物质的化学式为___。
(4)沉钒过程有气体生成,其反应的离子方程式为__。
(5)过滤后用乙醇代替水来洗涤沉淀的原因是__。
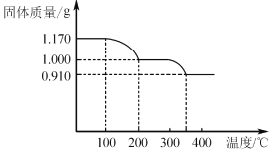
(6)煅烧NH4VO3时,固体质量随温度变化的曲线如图所示。加热到200℃时,得到的固体物质化学式为__,300~350℃放出的气态物质化学式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A能与NaOH溶液反应,其分子中含有苯环,相对分子质量为136,其中含碳的质量分数为70.6%,氢的质量分数为5.9%,其余为氧。
(1)A的分子式是_________。
若A能与NaHCO3溶液反应放出CO2气体,其结构有_____种。
(3)若A与NaOH溶液在加热时才能反应,且1mol A消耗1mol NaOH,则A的结构简式可能是___________________或者是_______________________。
(4)若A与NaOH溶液在加热时才能反应,且1mol A消耗2mol NaOH,则符合条件的A的结构可能有____种,其中能发生银镜反应的有____种,不能发生银镜反应的物质的结构简式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸铵[(NH4)2C2O4] 为无色柱状晶体,不稳定 ,受热易分解,可用于测定 Ca2+、Mg2+的含量。
I.某同学利用如图所示实验装置检验草酸铵的分解产物。
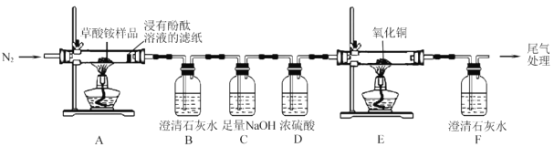
(1)实验过程中,观察到浸有酚酞溶液的滤纸变红,装置 B 中澄清石灰水变浑浊,说明分解产物中含有__________________(填化学式);若观察到__________________,说明分解产物中含有 CO。草酸铵分解的化学方程式为______________________。
(2)反应开始前 ,通入氮气的目的是________________________。
(3)装置 C 的作用是_______________________。
(4)还有一种分解产物在一定条件下也能还原CuO , 该反应的化学方程式为__________。
II.该同学利用草酸铵测定血液中钙元素的含量 。
(5)取 20.00 mL 血液样品 ,定容至 l00m L, 分别取三份体积均为25.00 mL 稀释后的血液样品,加入草酸铵,生成草酸钙沉淀,过滤,将该沉淀溶于过量稀硫酸中,然后用 0.0l00mol/L KMnO4 溶液进行滴定。滴定至终点时的实验现象为___________。三次滴定实验消耗 KMnO4 溶液的体积分别为0.43mL , 0.41 m L , 0.52mL, 则该血液样品中钙元素的含量为________m mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 盐酸普罗帕酮是一种高效速效抗心律失常药。合成此药的原料D的流程如下:

已知:
请回答以下问题:
(I)A的化学名称为____,试剂a的结构简式为____。
(2)C的官能团名称为____________。
(3)反应⑤的反应类型为____;反应①和⑤的目的为_______。
(4)满足下列条件的B的同分异构体还有 ___种(不包含B)。其中某同分异构体x能发生水解反应,核磁共振氢谱有4组峰且峰面积比为3:2:2:1,请写出x与NaOH溶液加热反应的化学方程式____。
①能发生银镜反应 ②苯环上有2个取代基
(5)关于物质D的说法,不正确的是____(填标号)。
a.属于芳香族化合物
b.易溶于水
c.有三种官能团
d.可发生取代、加成、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。下列说法不正确的是
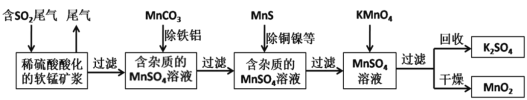
A.上述流程中多次涉及到过滤操作,实验室进行过滤操作时需用到的硅酸盐材质仪器有:玻璃棒、烧杯、漏斗
B.用MnCO3能除去溶液中的Al3+和Fe3+,其原因是MnCO3消耗了溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀
C.实验室用一定量的NaOH溶液和酚酞试液就可以准确测定燃煤尾气中的SO2含量
D.MnSO4溶液→MnO2过程中,应控制溶液pH不能太小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学化学反应原理,解决以下问题:
(1)请用离子方程式表示泡沫灭火器的工作原理___。
(2)请用离子方程式解释漂白粉和洁厕灵不能混合使用的原因___。
(3)难溶物ZnS可作为沉淀剂除去废水中的Cu2+,写出该过程的离子方程式___。
(4)用CO(g)还原80gFe2O3(s)生成Fe(s)和CO2(g),放热12.4kJ,请写出该反应的热化学方程式___。
(5)已知2CO(g)![]() CO2(g)+C(s),T=980K时,△H-T△S=0。在冶金工业中,以C为还原剂,温度高于980K时,C的氧化产物主要是___。
CO2(g)+C(s),T=980K时,△H-T△S=0。在冶金工业中,以C为还原剂,温度高于980K时,C的氧化产物主要是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com