
| A、工业生产中,合成氨采用压强越高,温度越低,越有利于提高经济效益 |
| B、增大催化剂的表面积,能加快合成氨的正反应速率、降低逆反应速率 |
| C、采用催化剂时,反应的活化能降低,使反应易达过渡态,故明显加快 |
| D、增大催化剂的表面积,能增大氨气的产率 |


科目:高中化学 来源: 题型:
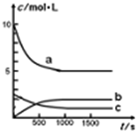 一定温度下,在体积为1L的恒容密闭容器中充入10mol NO2和2.5molO2发生反应:4NO2(g)+O2(g)?2N2O5(g)△H<0.反应混合物中NO2和物质的量浓度随时间的变化如表所示:
一定温度下,在体积为1L的恒容密闭容器中充入10mol NO2和2.5molO2发生反应:4NO2(g)+O2(g)?2N2O5(g)△H<0.反应混合物中NO2和物质的量浓度随时间的变化如表所示:| t/s | 0 | 500 | 1000 | 1500 |
| c(NO2)/mol?L-1 | 10 | 7 | 5 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3=2Na++CO32- |
| B、NaHSO4=Na++H++SO42- |
| C、H2SO4=H++SO42- |
| D、KClO3=K++ClO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
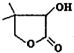 )常用于合成维生素类药物.下列与W相关说法正确的是( )
)常用于合成维生素类药物.下列与W相关说法正确的是( )| A、分子式为C6H9O3 |
| B、分子中含有2种官能团 |
| C、分子中含有6种不同化学环境的氢原子 |
| D、水溶液中1mol W可与3mol NaOH完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、16g O3与16g O2含有相同的氧原子数 |
| B、2.3g Na+中含有的电子数为0.1NA |
| C、1mol O2所含的原子数为NA |
| D、2.4g镁变为Mg2+时失去的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液时,分液漏斗中的两层液体均从下口放出 |
| B、蒸发食盐溶液,边加热边搅拌,直至把水蒸干得到干燥晶体 |
| C、称量NaOH固体时,将NaOH固体放在托盘天平左盘的纸上 |
| D、配制稀硫酸,在烧杯中加水,沿着烧杯内壁缓慢加入浓硫酸,并用玻璃棒不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所得溶液的物质的量浓度:c=1mol?L-1 | ||
| B、所得溶液中含有NA个HCl分子 | ||
| C、36.5g HCl气体在标准状况下占有的体积约为22.4L | ||
D、所得溶液的质量分数:w=36.5
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com