
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 |
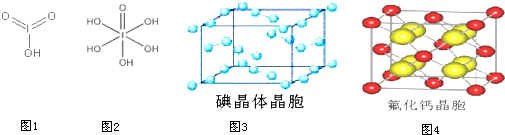
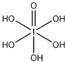 )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO3为一元酸,含有1个羟基氢,含非羟基氧原子2个,所以酸性:HIO3>H5IO6,故答案为:>;
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO3为一元酸,含有1个羟基氢,含非羟基氧原子2个,所以酸性:HIO3>H5IO6,故答案为:>;| 7+1-2×2 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| V |
| M×4 |
| VNA |
| a3ρNA |
| 4 |
| a3ρNA |
| 4 |


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
| A、洗净的容量瓶未经干燥就用于配制溶液 |
| B、未等溶液降至室温就转移至容量瓶 |
| C、转移溶液时不慎洒到容量瓶外 |
| D、定容时仰视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某芳香烃分子式为C9H12,其苯环上的一氯代物有两种的同分异构体有3种 |
| B、用溴水即可鉴别苯酚溶液、2,4-己二烯和甲苯 |
C、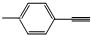 分子中所有原子共平面 分子中所有原子共平面 |
D、1.0 mol 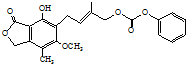 最多能与4.0 mol NaOH水溶液完全反应 最多能与4.0 mol NaOH水溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
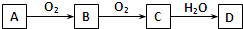
| A、A一定为单质 |
| B、C一定为氧化物 |
| C、D一定为酸 |
| D、A、B、C的相对分子质量之差为16或16的倍数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H2SO4 |
| NH3?H2O |
| △ |
| H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
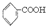 >H2CO3>
>H2CO3> >HCO3-将
>HCO3-将 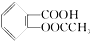 转变为
转变为 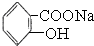 ,可行的方法是( )
,可行的方法是( )| A、向该溶液中加入足量的稀硫酸,加热 |
| B、将该物质与稀硫酸共热后,再加入足量的NaOH溶液 |
| C、将该物质与足量的NaOH溶液共热,再通入足量CO2气体 |
| D、将该物质与稀硫酸共热后,再加入足量的NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 醋酸浓度(mol?L-1) | 1 | 0.1 | 0.01 |
| pH值 | 2.50 | 3.00 | 3.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠加入滴有酚酞的水中,溶液变红:Na+2H2O═Na++2OH-+H2↑ |
| B、用NaOH溶液吸收多余的氯气:Cl2+2OH-═Cl-+ClO-+H2O |
| C、将NaHCO3溶液和过量Ca(OH)2溶液混合有白色沉淀:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
| D、将醋酸溶液滴到大理石上有气泡产生:2H++CaCO3═CO2↑+Ca2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl2 |
| B、CuSO4 |
| C、Na2CO3 |
| D、Ba(NO3)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com