
A.b=a/22.4 B.b<a/22.4 C.b>a/22.4 D.b≥a/11.2
| 从极端思维出发,讨论Cl2和H2量(体积)的极端,关键的关系式为Cl2~2NaOH。由题意知H2和Cl2的总体积为a dm3,即不管V(H2)和V(Cl2)怎样变化,总受V(H2)+V(Cl2)=a dm3制约。故当V(Cl2)→a时,V(H2)→0(→表示趋向);当V(H2)→a时,V(Cl2)→0。
由Cl2+H2=2HCl,HCl+NaOH=NaCl+H2O,Cl2+2NaOH=NaCl+NaClO+H2O可知无论H2过量,或Cl2过量,Cl2总是全部直接或间接地与NaOH作用完,且必有 Cl2 ~ 2NaOH 1 mol 2mol V(Cl2)/22.4 b ∴ b=V(Cl2)/11.2 当V 当V 故0<b<
|


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 国务院强调,“南水北调”工程必须坚持节水、治污和生态环境保护与工程建设相协调,以水资源合理配置为主线,把节水、治污、生态环境保护与调水作为一个完整的系统来分析的原则.在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题:
国务院强调,“南水北调”工程必须坚持节水、治污和生态环境保护与工程建设相协调,以水资源合理配置为主线,把节水、治污、生态环境保护与调水作为一个完整的系统来分析的原则.在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
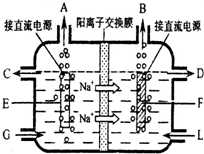 四川盛产井盐,由井盐提取的食盐是日常生活必需品,也是重要的化工原料.
四川盛产井盐,由井盐提取的食盐是日常生活必需品,也是重要的化工原料.2- 4 |
| 加入试剂 |
| 过滤 |
| 适量盐酸 |
| 蒸发、结晶、烘干 |
2- 4 |
| ||
| ||
| ||
ρV1-
|
| ||
ρV1-
|
查看答案和解析>>
科目:高中化学 来源: 题型:


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
A.甘油 B.甲醇 C.乙醇 D.乙二醇
查看答案和解析>>
科目:高中化学 来源:2014届四川省高一下半期考试化学试卷(解析版) 题型:推断题
(9分)有A、B、C、D、E五种元素,A元素形成的-2价阴离子比氦的核外电子数多8个。B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质。C为原子核内有12个中子的二价金属,当2.4 g C与足量盐酸反应时,生成标准状况下的H2 2.24 L。D的原子M层上有7个电子,E与A同周期且最外层比次外层多3个电子。
(1)C离子的结构示意图 。
(2)A、E氢化物的稳定性比较 。(填化学式)
(3)A、B、C、D四种离子半径由大到小顺序 (用离子符号表示)。
(4)用电子式表示C与D形成化合物的形成过程:
。
(5)写出D单质与B的最高价氧化物对应水化物反应的离子方程式:
。
(6)写出Cu与E的最高价氧化物对应水化物稀溶液反应的离子方程式:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com