
分析 (1)根据元素化合价代数和为零来计算回答;
(2)①中Cu的化合价降低,硫的化合价升高;②中S元素的化合价升高,O元素的化合价降低;③中,Cu2S中Cu元素的化合价降低,S元素的化合价升高,根据氧化还原反应中的基本概念来回答;
(3)由反应可知,存在6Cu~3Cu2S~6CuFeS2~15O2,以此分析;
(4)Cu元素由+1价降低为0,O元素的化合价降低,而S元素的化合价由-2价升高为+4价,据此计算.
解答 解:(1)CuFeS2中Fe是+2,S是-2价,根据元素化合价代数和为零,Cu的化合价是+2,故答案为:+2;
①中Cu、O的化合价降低,硫的化合价升高,CuFeS2既是氧化剂又是还原剂,氧气是氧化剂;②中S元素的化合价升高,O元素的化合价降低,Cu2S只做还原剂,氧气是氧化剂;③中,Cu2S中Cu元素的化合价降低,S元素的化合价升高,Cu2S既是还原剂又是氧化剂,Cu2O是氧化剂,化合价升高值=失电子数=化合价降低值=得电子数=转移电子数,各个反应电子转移情况如下:①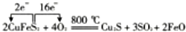 ②
② ③
③ ;
;
故答案为:①CuFeS2、O2是氧化剂,CuFeS2,是还原剂,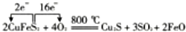 ;②Cu2S还原剂,O2是氧化剂;
;②Cu2S还原剂,O2是氧化剂; ;③Cu2S、Cu2O是氧化剂,Cu2S是还原剂,
;③Cu2S、Cu2O是氧化剂,Cu2S是还原剂, ;
;
(3)由反应可知,存在6Cu~3Cu2S~6CuFeS2~15O2,则1mol CuFeS2生成1molCu,理论上消耗2.5molO2,故答案为2.5;
(4)Cu元素由+1价降低为0,O元素的化合价降低,而S元素的化合价由-2价升高为+4价,则转移的电子数为1mol×[4-(-2)]=6mol,故答案为:6;
点评 本题考查氧化还原反应,为高考常见题型,注意把握元素的化合价及反应中的变化为解答的关键,侧重基本概念的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 15mol、25% | B. | 20mol、75% | C. | 20mol、50% | D. | 40mol、80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素乙酸酯、油脂和蛋白质都是能发生水解反应的高分子化合物 | |
| B. | 蔗糖、淀粉、油脂及其水解产物均为非电解质 | |
| C. | 若两种二肽互为同分异构体,则两者的水解产物不一致 | |
| D. | 蛋白质溶液能发生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和pH和体积均相同的盐酸和醋酸溶液,消耗相同浓度的NaOH的体积较多的是醋酸 | |
| B. | FeCl3溶液和Fe2(SO4)3溶液蒸干、灼烧都得到Fe2O3 | |
| C. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小 | |
| D. | 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,0.5mol N2和1.5molH2置于密闭容器中充分反应生成氨气,放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 在100℃、101 kPa条件下,液态水的气化热为40.69 kJ•mol-1,则H2O(g)?H2O(l) 的△H=+40.69 kJ•mol-1 | |
| D. | 酸碱发生中和反应生成1mol液态H2O时,所放出的热量称为中和热,可表示为:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com