
分析 (1)CaCO3不溶于水,可用过滤的方法分离;
(2)乙醇易挥发,可用蒸馏的方法提纯;
(3)胶体不能透过半透膜,而离子、分子可以;
(4)二者的溶解度受温度影响不同.
解答 解:(1)CaCO3不溶于水,可用过滤的方法分离,故答案为:①;
(2)乙醇易挥发,而NaCl难挥发,则可用蒸馏的方法提纯,故答案为:③;
(3)胶体不能透过半透膜,而离子、分子可以,则选择渗析法可分离,故答案为:⑤;
(4)NaCl的溶解度受温度影响不大,而硝酸钾的溶解度受温度影响变化大,则选择蒸发结晶法除去NaCl中混有少量KNO3,故答案为:②.
点评 本题考查物质的分离、提纯,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握物质的性质的异同为解答该题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 向KAl(SO4)2溶液中加入Ba(OH)2至SO42-完全沉淀:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O | |
| B. | 偏铝酸钠溶液中加过量HCl:AlO2-+4H+=Al3++H2O | |
| C. | 向NH4HSO3溶液中滴入适量NaOH溶液:HSO3-+OH-=SO32-+H2O | |
| D. | 电镀铜时阳极反应为:Cu2++2e-=Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 依据丁达尔现象可将分散系划分为溶液、胶体与浊液 | |
| B. | PM2.5(微粒直径约为2.5×10-6 m)分散在空气中形成气溶胶 | |
| C. | 光导纤维、聚乙烯、油脂都是高分子化合物 | |
| D. | 大雾的形成与汽车的尾气排放有很大关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用待测液润洗滴定用的锥形瓶 | |
| B. | 常温下,某同学用pH试纸测得KCl溶液的pH约为7.0 | |
| C. | 配制Fe2(SO4)3溶液时,先把Fe2(SO4)3晶体溶于浓硫酸后稀释 | |
| D. | 用碱式滴定管准确移取KMnO4溶液,体积为21.50mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| B. | NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 稀硝酸和过量的铁屑反应:3 Fe+8H++2 NO3-=3 Fe3++2 NO↑+4 H2O | |
| D. | 大理石溶于醋酸的反应:CaCO3+CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度和压强下,气态物质的体积主要由构成气体的分子的大小决定 | |
| B. | 从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液中氢离子的浓度为4mol/L | |
| C. | 同温同压下,30mLA2气体和10mL B2气体恰好完全反应生成20mLC气体,则C化学式为 A3 B或B A3 | |
| D. | 同温同压下任何气体的分子间距离几乎相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2为V形的极性分子 | |
| B. | ClO3- 的空间构型为平面三角形 | |
| C. | SF6中S原子和氟原子均满足最外层8电子稳定结构 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化,SiF4分子呈空间正四面体,SO32-呈三角锥形 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
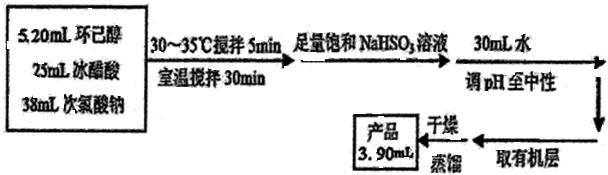
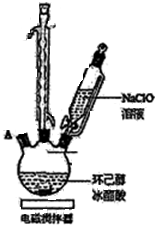 环己酮是重要化工原料,可用于制造尼龙、己二酸产品.可以尝试用次氯酸钠氧化环己醇制备环己酮:
环己酮是重要化工原料,可用于制造尼龙、己二酸产品.可以尝试用次氯酸钠氧化环己醇制备环己酮:
| 密度g/cm3 | 沸点℃ | 熔点℃ | 水溶性 | |
| 乙酸 | 1.05 | 117.9 | 16.6 | 易溶 |
| 环己醇 | 0.96 | 160.8 | 25.9 | 微溶 |
| 环己酮 | 0.95 | 155 | -4.5 | 能溶 |
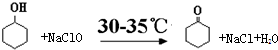 .
. ),其最可能的原因是A(填写选项编号)
),其最可能的原因是A(填写选项编号)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com