
【题目】用NA表示阿伏伽德罗常数,下列说法正确的有( )
A.1molNa2O2晶体中共含有4NA个离子
B.0.1mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒
C.常温常压下16gO2和O3混合气体含有NA个氧原子
D.1mol/LNa2CO3溶液中含有NA个CO32﹣
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常温下0.1molL﹣1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( )
A.将溶液稀释到原体积的10倍
B.加入适量的醋酸钠固体
C.加入等体积0.2 molL﹣1盐酸
D.提高溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g) ![]() H2(g)+I2(g)达到平衡时,c(H2)=1 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
H2(g)+I2(g)达到平衡时,c(H2)=1 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
A. 36 B. 24 C. 16 D. 9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知破坏1mol H﹣H键、1mol I﹣I键、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘单质反应生成2mol HI需要放出kJ的热量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或说法正确的是( )
A. 甲烷的燃烧热为ΔH=-890 kJ·mol-1 ,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890 kJ· mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. 已知:H2(g)+F2(g)=2HF(g) ΔH=-270 kJ·mol-1 ,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
D. 在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)CO(g)+2H2(g)CH3OH(g)△H
如表所列数据是反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应的△H0(填“>”、“=”或“<”).能够说明某温度下该反应是平衡状态的是
A.体系的压强不变 B.密度不变 C.混合气体的相对分子质量 D.c(CO)=c(CH3OH)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K=(保留3为有效数字)
(2)在某温度和压强下,将一定量H2和O2充入密闭容器发生反应:
2H2(g)+O2(g)2H2O(g)△H=﹣241.8KJ/mol,平衡后压缩容器体积至原来的 ![]() ,其他条件不变,对平衡体系产生的影响是 (填序号):
,其他条件不变,对平衡体系产生的影响是 (填序号):
a.平衡常数K增大; b.正反应速率加快,逆反应速率减慢; c.重新平衡c(H2)/c(H2O)减小.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以有机物A为原料可以合成药物SERMs的中间体E。其合成路线如下:

回答下列问题:
(1)A的化学名称为_________;E中官能团的名称为________________。
(2)A~B的反应类型为________,B→C的反应类型为________________。
(3)B的结构简式为_________________。
(4)由D生成E的化学方程式为__________________。
(5)二取代芳香族化合物W是E的同分异构体,符合下列条件的W共有___种(不含立体异构)。
①1molW能与足量银氨溶液发生银镜反应生成4molAg
②能与FeCl3溶液发生显色反应
其中核磁共振氢谱为六组峰的结构简式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法正确的是
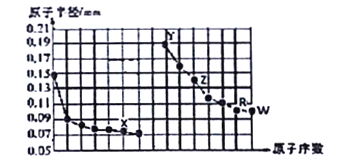
A. X所在主族中,X的简单氢化物分子间存在氢键,所以其氢化物稳定性最强
B. R简单氢化物的酸性弱于W简单氢化物,故元素非金属性R小于W
C. 在同周期中,W的含氧酸酸性最强
D. 已知Z的一种金属储氢材料LiZH4(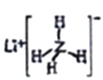 )遇水剧烈反应放出H2,则反应方程式为:LiZH4+2H2O=LiZO2+4H2↑
)遇水剧烈反应放出H2,则反应方程式为:LiZH4+2H2O=LiZO2+4H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态,铈的合金耐高温,可以用来制造喷气推进器零件。
请回答下列问题:
(1)雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(二者物质的量之比为1:1),该反应氧化剂与还原剂的物质的量之比为________。
(2)可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。

①Ce4+从电解槽的______(填字母序号)口流出。
②写出阴极的电极反应式________________。
(3)铈元素在自然界中主要以氟碳矿形式存在。主要化学成分为CeFCO3。工业上利用氟碳铈矿提取CeCl3的一种工艺流程如下:

①焙烧过程中发生的主要反应方程式为__________________。
②有同学认为酸浸过程中用稀硫酸和H2O2替换盐酸更好,他的理由是_________。
③Ce(BF4)3、KBF4的Ksp分别为a、b,则Ce(BF4)3(s)+3KCl(aq)![]() 3KBF4(s)+CeCl3(aq)平衡常数为________(用a、b的代数式表示)。
3KBF4(s)+CeCl3(aq)平衡常数为________(用a、b的代数式表示)。
④加热CeCl3·6H2O和NH4Cl的固体混合物可得固体无水CeCl3,其中NH4Cl的作用是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com