
分析 (1)过氧化银(Ag2O2)作为活性物质,广泛应用于抗菌消毒,可能是因为过氧化银具有强氧化性;
(2)由反应方程式:2AgNO3+4KOH+K2S2O8$\frac{\underline{\;\;△\;\;}}{\;}$Ag2O2↓+2KNO3+2K2SO4+2H2O得到K2S2O8~~Ag2O2↓进行计算求解;
(3)①用NaClO-NaOH溶液氧化AgNO3,制得高纯度的纳米级Ag2O2.同时生成氯化钠和水,结合原则守恒和电荷守恒配平书写离子方程式;
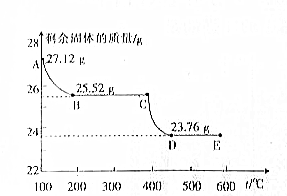
②AB段质量变化=27.12g-25.52g=1.6g,说明失去的为氧气质量,过氧化银分解生成氧化银河氧气,发生的反应为:2Ag2O2$\frac{\underline{\;\;△\;\;}}{\;}$2Ag2O+O2↑;BC段质量变化=25.52g-23.76g=1.76g,是氧化银分解生成银和氧气;依据分解反应的定量关系和质量变化,结合元素守恒计算.
解答 解:(1)过氧化银(Ag2O2)作为活性物质,广泛应用于抗菌消毒,可能是因为过氧化银具有强氧化性,Ag为重金属元素,有消毒杀菌功能;
故答案为:具有强氧化性或Ag为重金属元素,有消毒杀菌功能;
(2)由反应方程式:2AgNO3+4KOH+K2S2O8$\frac{\underline{\;\;△\;\;}}{\;}$Ag2O2↓+2KNO3+2K2SO4+2H2O得到
K2S2O8~~Ag2O2↓
252 248
27.0g m
所以m=$\frac{248×27g}{252}$=26.57g,故答案为:26.57g;
(3)①用NaClO-NaOH溶液氧化AgNO3,制得高纯度的纳米级Ag2O2.同时生成氯化钠和水,结合原则守恒和电荷守恒配平书写离子方程式2Ag++ClO-+2OH-=Ag2O2↓+Cl-+H2O;
故答案为:2Ag++ClO-+2OH-=Ag2O2↓+Cl-+H2O;
②AB段质量变化=27.12g-25.52g=1.6g,说明失去的为氧气质量,过氧化银分解生成氧化银河氧气,发生的反应为:2Ag2O2$\frac{\underline{\;\;△\;\;}}{\;}$2Ag2O+O2↑;BC段质量变化=25.52g-23.76g=1.76g,是氧化银分解生成银和氧气,化学方程式为:2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑;
AB段发生的反应为:2Ag2O2$\frac{\underline{\;\;△\;\;}}{\;}$2Ag2O+O2↑;
n(O2)=$\frac{27.12g-25.52g}{32g/mol}$=0.0500mol;
n(Ag2O2)=2n(O2)=2×0.0500mol=0.1000mol;
w(Ag2O2)=$\frac{0.1000mol×248g/mol}{27.12g}$×100%=91.45%,故答案为:2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑;91.45%;
点评 本题考查了物质组成的实验测定和数据分析计算,图象理解应用,化学反应方程式的书写,掌握基础是关键,题目难度中等.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 用硝酸银溶液区分碳酸钠和氯化钠 | |
| B. | 用硝酸钡溶液区分碳酸钠和硫酸钠 | |
| C. | 用氯化钙溶液区分碳酸钠和碳酸氢钠 | |
| D. | 用盐酸区分氢氧化钠和氯化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与Cl2、盐酸均能发生反应生成FeCl3 | |
| B. | 加热蒸干并灼烧铁、铝的氯化物溶液,最后均得到金属氧化物 | |
| C. | 等物质的量的Na、Cu、Al与足量氯气反应时消耗氯气一样多 | |
| D. | 常温下铁片、铝片与浓硫酸不能发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属是日常生活和工农业生产中广泛使用的材料.恰当的金属防腐方法是延长金属材料使用寿命的前提.
金属是日常生活和工农业生产中广泛使用的材料.恰当的金属防腐方法是延长金属材料使用寿命的前提.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H10O2,一定能与金属钠反应放出气体 | |
| B. | 甲苯分子中所有原子可能共面 | |
| C. | 生物柴油在NaOH溶液水解可得一种羧酸盐 | |
| D. | 乙醇、甲苯、葡萄糖能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com