
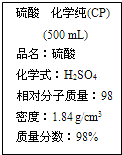
| A. | 该硫酸与等质量的水混合后所得溶液的浓度大于9.2 mol/L | |
| B. | 1 mol Mg与足量该硫酸反应产生2 g氢气 | |
| C. | 配制250 mL 1.0 mol/L的稀硫酸需取该硫酸约13.6mL | |
| D. | 该硫酸溶液可作H2S的干燥剂 |
分析 A.浓硫酸浓度越大其密度越大,硫酸密度大于水密度,等质量硫酸和水,水的体积大于硫酸体积;
B.Mg和浓硫酸反应生成二氧化硫;
C.根据c=$\frac{1000ρω}{M}$计算出该硫酸的浓度,溶液配制过程中溶质的物质的量不变,据此计算出需要该浓硫酸的体积;
D.浓硫酸具有强氧化性,能够氧化硫化氢.
解答 解:A.浓硫酸浓度越大其密度越大,硫酸密度大于水密度,等质量硫酸和水,水的体积大于硫酸体积,所以二者混合后溶液体积大于浓硫酸的二倍,则其物质的量浓度小于原来的$\frac{1}{2}$,即小于9.2mol/L,故A错误;
B.Mg和浓硫酸反应生成二氧化硫,稀硫酸和锌反应生成氢气,故B错误;
C.溶液稀释前后溶质的物质的量不变,该浓硫酸浓度为:$\frac{1000×1.84×98%}{98}$=18.4mol/L,配制250 mL 1.0 mol/L的稀硫酸需取该硫酸体积为:$\frac{1.0mol/L×0.25L}{18.4mol/L}$=0.0136L=13.6mL,故C正确;
D.H2S具有较强还原性,浓硫酸能够氧化H2S,不能用浓硫酸干燥H2S,故D错误;
故选C.
点评 本题考查物质的量浓度的有关计算,题目难度不大,明确物质的性质、溶液稀释特点等知识点即可解答,易错选项是A,浓硫酸浓度越大其密度越大,氨水浓度越大其密度越小,试题培养了学生的分析能力及化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| B. | 凡含有食品添加剂的食物对人体健康均有害,不可食用 | |
| C. | 为了防止缺碘而导致大脖子病,故在食盐中加入KIO3 | |
| D. | 钠钾合金可以作为原子反应堆的导热剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.004(mol•L-1•min-1) | B. | 0.008(mol•L-1•min-1) | ||
| C. | 0.016(mol•L-1•min-1) | D. | 0.032(mol•L-1•min-1) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑥ | B. | ②③ | C. | ①④ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,OH-向负极移动 | |
| B. | 放电时负极反应式:Zn-2e-+2OH-═Zn(OH)2 | |
| C. | 充电时,与外电源正极相连的电极上电极反应式为Ni(OH)2-e-+OH-═NiOOH+H2O | |
| D. | 该电池电解1L 0.3 mol/LAgNO3溶液,若产生1.12L气体(标准状况),溶液pH变为2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、丙烯、丁烯的混合气体共14g,其含有的原子数为3NA | |
| B. | 15g甲基(-CH3)所含有的电子数为10NA | |
| C. | 1.8g重水(D2O)含质子数为NA | |
| D. | 标准状况下,11.2L二氯甲烷所含分子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com