
【题目】SO2是评价空气质量的污染物之一,主要来源于硫酸工厂的尾气和含硫燃料的燃烧。
(1)硫酸厂尾气一般采用吸收法处理。
①已知Ka(H2SO3)=1.54x10-2,Ka(HSO3-)=1.02x10-7,Kb(NH3·H2O)=1.77x10-5,将标准状况下11.2L SO2通入到2L0.5mol·L-1的氨水中,所得溶液中溶质是__________(填化学式),该溶液呈______________(填“酸”“碱”或“中”)性。
②下列关于①所得的溶液的关系正确的是_____________(填序号)。
A.2[c(NH4+)+c(NH3·H2O)]=c(SO32-)+c(HSO3-)+c(H2SO3)
B.c(NH4+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
C.c(NH4+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
D.c(NH4+)+c(OH-)=c(HSO3-)+2c(H2SO3)+c(H+)
③常温下,若用1LNaOH溶液吸收0.01mol SO2,完全吸收后溶液中c(Na+)= c(SO32-)+c(HSO3-)+ c(H2SO3),则原NaOH溶液的pH值为___________。
(2)燃煤烟气中可通过下列反应实现硫的回收:SO2(g)+2CO(g)![]() 2CO2(g)+S(l)
2CO2(g)+S(l)
①该反应的平衡常数表达式是____________。
②恒温恒压下,5分钟时,反应到达平衡,气体密度减小16g·L-1,则0-5分钟内CO的反应速率是__________,若升高温度气体的密度增加,则该反应的△H__________0(填“>”或“<”)。
③下列措施,既能提高该反应的反应速率,又能提高SO2的吸收率的是__________(填序号)。
A. 加压 B.增加SO2的浓度
B. 升高温度 D.移走产物
(3)SO2还能被多种物质吸收。
①写出SO2与Ba(NO3)2溶液反应的离子方程式:_______________。
②如果用含等物质的量溶质的下列个溶液分别吸收SO2,则理论吸收量由多到少的顺序是__________(用序号排序)。
A. H2S B.Na2SO3
C.BaCl2 D.酸性KMnO4
【答案】(1)①(NH4)2SO3;碱性;②C;③12
(2)①![]() ;②0.2mol/Lmin;<;③A
;②0.2mol/Lmin;<;③A
(3)①2NO3-+3Ba2++3SO2+2H2O=2NO+3BaSO4↓+4H+;②DBAC
【解析】
试题分析:(1)①标准状况下11.2L SO2的物质的量为0.5mol,含氨的物质的量为2L×0.5mol·L-1=1mol的氨水中,所得溶液中溶质是(NH4)2SO3;由于Ka(HSO3-)=1.02x10-7小于Kb(NH3·H2O)=1.77x10-5,所以该溶液呈碱性。故答案为:(NH4)2SO3;碱性;
②①所得的溶液的溶质为(NH4)2SO3。A.依据质量数:c(NH3)+c(NH4+)+c(NH3·H2O)=2[c(SO32-)+c(HSO3-)+c(H2SO3)],故A错误;B.依据电荷守恒:c(NH4+)+c(H+)= 2c(SO32-)+c(HSO3-)+c(OH-),故B错误;C.(NH4)2SO3溶液中离子浓度大小关系为:c(NH4+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),故C正确;D.依据质量守恒关系式,且溶液呈碱性,则c(NH4+)+ c(OH-)>c(HSO3-)+2c(H2SO3)+ c(H+),故D错误。故答案为:C;
③常温下,若用1LNaOH溶液吸收0.01molSO2,完全吸收后溶液中c(Na+)= c(SO32-)+c(HSO3-)+ c(H2SO3),说明n(NaOH)=n(SO2)=0.01mol,则原NaOH溶液的c(H+)=Kw/c(OH-)=10-12mol/L,pH值为12。故答案为:12;
(2)①燃煤烟气中可通过下列反应实现硫的回收:SO2(g)+2CO(g)![]() 2CO2(g)+S(l),则该反应的平衡常数表达式是
2CO2(g)+S(l),则该反应的平衡常数表达式是![]() 。故答案为:
。故答案为:![]() ;
;
②已知恒温恒容下,S不是气体,且5分钟时,反应到达平衡,气体密度减小16g·L-1,则0-5分钟内CO的浓度变化量为:△c(CO)=2×16g·L-1÷32g/mol=1.0mol/L,v(CO)=1.0mol/L÷5min=0.2mol/L min;依据方程式可知,S不是气体,该反应的正反应是气体密度减小的反应,若升高温度气体的密度增加,则该反应的△H<0。故答案为:0.2mol/L min;< ;
③A.加压化学反应速率增大,平衡向正反应方向移动,SO2的吸收率提高,故A正确;B.增加SO2的浓度化学反应速率增大,平衡向正反应方向移动,但SO2的吸收率降低,故B错误;C.升高温度化学反应速率增大,平衡向逆反应方向移动,SO2的吸收率降低,故C错误;D.移走产物化学反应速率减小,平衡向正反应方向移动,SO2的吸收率提高,故D错误。故答案为:A;
(3)①SO2还能被Ba(NO3)2溶液吸收,SO2与Ba(NO3)2溶液反应的离子方程式:2NO3-+3Ba2++3SO2+2H2O = 2NO+3BaSO4 ↓+4H+。
②依据化学方程式可知,如果均用含1mol溶质的下列个溶液分别吸收SO2,则理论吸收量A.H2S吸收0.5mol;B.Na2SO3吸收1mol;C.BaCl2与SO2不反应,不能吸收SO2;D.酸性KMnO4吸收2.5mol。即由多到少的顺序是DBAC。故答案为:DBAC。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化学与新型材料、环境保护、能源开发等密切相关。下列说法错误的是( )
A.人造纤维、合成橡胶和光导纤维都属于有机高分子化合物
B.使用生物酶降解生活废水中的有机物,可防止水体的富营养化
C.上海世博会很多展馆采用光电转化装置,体现当今“低碳”经济的理念
D.利用二氧化碳等原料合成聚碳酸酯类可降解塑料,有利于减少白色污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2mol 由两种气态烃组成的混合物完全燃烧得0.28mol 二氧化碳和7.2g水。下列关于该混合物的说法正确的是
A. 一定含有甲烷 B. 一定含有乙烯 C. 可能含有乙烷 D. 可能含有乙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ滴定曲线如阁所示。下列说法不正确的是
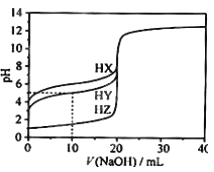
A.在相同温度下,同浓度的三种酸酸性强弱顺序:HX<HY<HZ
B.根据滴定曲线,可得Ka(HY)≈10-5
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+)
D.HY与HZ混合,达到平衡时:c(H+)=c(Y-)+c(Z-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物华素片(西地碘片)使用说明书的部分内容如下:

根据上述说明和所学化学知识回答:
(1)华素片中含有的活性成分是 (写分子式);
(2)某学生为验证华素片中确定含有上述活性成分,完成实验如下,请填写:
① 将药片研碎、溶解、过滤,所得滤液分装于甲、乙两试管中备用。
② 在甲试管中加入下列一种试剂,振荡、静置,观察到液体分层,若上层液体颜色为无色,则所加试剂为下列中的 (填字母),由此说明存在分子碘。
A.氢氧化钠溶液 B.酒精 C.四氯化碳 D.盐酸
③ 在乙试管中滴加 溶液,溶液变蓝色,也能说明存在分子碘。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用二氧化锰和浓盐酸共热的方法制取氯气,反应中二氧化锰被还原为MnCl2。根据要求回答下列问题:
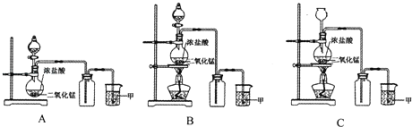
(1)A、B、C三套装置中,应选用的装置是 (选填“A”、“B”、“C”)。
(2)写出实验室用上述方法制取氯气的化学方程式 。
(3)为了防止氯气污染环境,图中所示的溶液甲为 ,在该溶液中发生反应的化学方程式 。
(4)利用该原理和装置进行实验,制得的氯气中往往含有的杂质有 ,可依次通入到 除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列仪器不能用酒精灯直接加热的是
①烧杯 ②坩埚 ③蒸发皿 ④试管 ⑤蒸馏烧瓶 ⑥锥形瓶 ⑦燃烧匙
A. ③⑥⑦ B. ①⑤⑥ C. ①⑤ D. ⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关Al与NaOH溶液反应的说法正确的是( )
A.Al是还原剂,NaOH及H2O均是氧化剂
B.还原产物是H2,且由H2O还原所得的H2与NaOH还原所得的H2物质的量之比为2∶1
C.此反应说明铝具有两性,铝的活泼性比只具有金属性的金属弱
D.此反应中,只有水是氧化剂,NaOH既不是氧化剂也不是还原剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com