
| A. | 液态氯化氢 | B. | 熔融态的食盐 | C. | 硫酸铜溶液 | D. | 稀硫酸 |
分析 电解质是指:在水溶液或熔化状态下能导电的化合物.对照各选项既要是化合物,又在水溶液或熔化状态下能导电,且无水溶液或熔融状态不能导电,据此判断即可.
解答 解:A、HCl在水溶液中能导电,故为电解质;但在液态时共价键不能断裂,无自由移动的离子,故不能导电,故A正确;
B、熔融状态的食盐能导电,但由于食盐是混合物,故既不是电解质也不是非电解质,故B错误;
C、硫酸铜溶液能导电,但由于是混合物,故既不是电解质也不是非电解质,故C错误;
D、稀硫酸能导电,但由于是混合物,故既不是电解质也不是非电解质,故D错误;
故选A.
点评 本题重点考查了电解质概念的辨析,解题时紧抓住电解质必须是化合物,以及导电是在水溶液或熔化状态下为条件进行解题.


科目:高中化学 来源: 题型:解答题
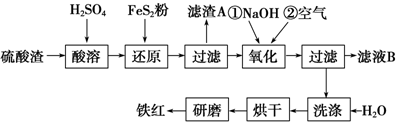
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1 | B. | 1:3 | C. | 4:1 | D. | 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3+3CO(g)?2Fe(s)+3CO2(g)△H=akJ•mol-1
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3+3CO(g)?2Fe(s)+3CO2(g)△H=akJ•mol-1| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属材料都是导体,非金属材料都是绝缘体 | |
| B. | 工业制硫酸、硝酸的关键步骤都应用了催化氧化的方法 | |
| C. | 水泥、玻璃、光导纤维都是硅酸盐产品 | |
| D. | 钠、铝、铁、硫、氯等元素在自然界中只有化合态存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W均为短周期元素,在周期表中位置如图所示.Y原子的最外层电于数是内层
X、Y、Z、W均为短周期元素,在周期表中位置如图所示.Y原子的最外层电于数是内层| A. | 气态氢化物的稳定性:Y>Z | |
| B. | 最高价氧化物物对应水化物酸性:Z>W | |
| C. | X的气态氢化物与Y、Z、W的气态氢化物都可以反应 | |
| D. | 气态氢化物的沸点,Y最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
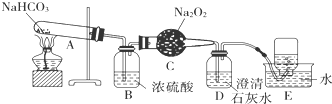
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com