
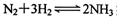 实现储氢和输氢。下列说法正确的是 ;
实现储氢和输氢。下列说法正确的是 ;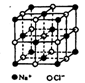
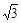 r(2分)
r(2分) 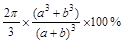 (2分)
(2分)  (2分)
(2分)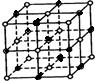 ,从图中可以看出,钠离子在体心和棱心位置,氯离子在顶点和面心位置,Na+与跟它次近邻的C1—(也就是图中晶胞大立方体中的8个顶点小白圈 )个数为8个,该Na+与跟它次近邻的Cl—之间的距离也就是边长为r的小立方体的体对角线,也就是
,从图中可以看出,钠离子在体心和棱心位置,氯离子在顶点和面心位置,Na+与跟它次近邻的C1—(也就是图中晶胞大立方体中的8个顶点小白圈 )个数为8个,该Na+与跟它次近邻的Cl—之间的距离也就是边长为r的小立方体的体对角线,也就是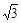 r 。
r 。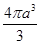 pm3,一个Cl-体积是
pm3,一个Cl-体积是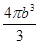 pm3,4个Na+和Cl-体积是
pm3,4个Na+和Cl-体积是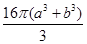 pm3,氯化钠晶体中离子的空间利用率为
pm3,氯化钠晶体中离子的空间利用率为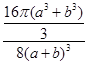 ×100%=
×100%=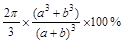 。
。 =26%,另外列一种比较直观明了的解法: 由于立方体中的总原子数为n3(n为棱上原子数) 因此边长为氯化钠晶胞边长的10倍的氯化钠颗粒中总原子数为213,而其内部的总原子数为193(相当于将外面剥掉一层),所以其表面的原子数为213-193。表面原子占总原子数的百分数:
=26%,另外列一种比较直观明了的解法: 由于立方体中的总原子数为n3(n为棱上原子数) 因此边长为氯化钠晶胞边长的10倍的氯化钠颗粒中总原子数为213,而其内部的总原子数为193(相当于将外面剥掉一层),所以其表面的原子数为213-193。表面原子占总原子数的百分数: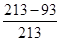 =26%。
=26%。

科目:高中化学 来源:不详 题型:填空题
 CH2、②HC≡CH、③
CH2、②HC≡CH、③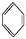 、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形。
、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形。 
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 键与
键与 键的个数比为 。
键的个数比为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2SeO3 | B.HMnO4 | C.H3BO3 | D.H3PO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com