
【题目】碳和氮的氢化物是广泛的化工原料,回答下列问题:
(1)工业上合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g) △H=-92.2kJ/mol,反应过程中能量变化如图I所示。
2NH3(g) △H=-92.2kJ/mol,反应过程中能量变化如图I所示。

①氨分解:2NH3(g)![]() N2(g)+3H2(g)的活化能为_________kJ/mol
N2(g)+3H2(g)的活化能为_________kJ/mol
②合成氨时加入铁粉可以加快生成NH3的速率,在图I中画出加入铁粉后的能量变化曲线。_______
(2)联氨作火箭燃料的反应为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H1
已知:2O2(g)+N2(g)=N2O4(1) △H2 N2H4(1)+O2(g)=N2(g)+2H2O(g) △H3
上述热效应之间的关系式为△H1=____。某新型火箭用液氧/煤油代替联氨/N2O4,这种替换可能的好处是___(一条即可)。
(3)天然气制氢气是工业上制氢气的主要方法之一,其主要反应如下:
i.CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=-+206.4kJ/mol,
CO(g)+3H2(g) ΔH=-+206.4kJ/mol,
ii.CO(g)+ H2O(g)![]() CO2(g)+H2(g) ΔH=-41.0kJ/mol
CO2(g)+H2(g) ΔH=-41.0kJ/mol
在一定温度下,2L的密闭容器中加入a molCH4和2amolH2O发生反应,t min时反应达平衡,测得容器内CObmol、CO2cmol。回答下列问题:
①下列可判断体系达到平衡状态的是_______。
A.CO的体积分数不变 B.容器内气体密度不变 C.3v(CH4)=v(H2) D.![]() 不再变化
不再变化
②0~tmin反应速率v(CO2)=_____,CH4的的转化率为_____,反应ⅱ的平衡常数K=______。
③图Ⅱ中T℃之后c(CO2)随温度升高而减小的原因是_________。

【答案】427.7 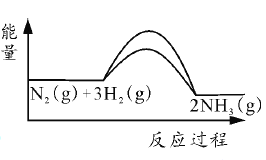 2△H3-△H2 环境污染小(或成本低) AD
2△H3-△H2 环境污染小(或成本低) AD ![]() mol/(L·min)
mol/(L·min) ![]() ×100%
×100% ![]() T℃之后,反应②为放热反应,升高温度反应②向逆反应方向移动是影响c(CO2)的主要因素,故c(CO2)减小
T℃之后,反应②为放热反应,升高温度反应②向逆反应方向移动是影响c(CO2)的主要因素,故c(CO2)减小
【解析】
(1)①放热反应的反应热△H=—(Ea2—Ea1);
②催化剂可以降低反应的活化能,增大反应速率,即Ea、Ea1均减小,但反应热不变;
(2)依据盖斯定律计算可得;液氧/煤油所用原料成本低,无毒;
(3)①反应达到化学平衡状态时,正逆反应速率相等,各物质浓度或百分含量保持不变;
②依据题给数据,建立三段式,结合速率、转化率和化学平衡常数表达式计算可得;
③反应i为吸热反应,反应ii为放热反应,由图Ⅱ可知T℃时反应达到平衡,升高温度,反应i向正反应方向移动,一氧化碳浓度增大,反应ii向逆反应方向移动,温度对c(CO2)的影响大于浓度的影响。
(1)①放热反应的反应热△H=—(Ea2—Ea1),由图可知Ea1=335.0 kJ/mol,则合成氨反应△H=—(Ea2—335.0 kJ/mol)=—92.2kJ/mol,Ea2=427.2 kJ/mol,即2NH3(g)![]() N2(g)+3H2(g)的活化能为427.2 kJ/mol,故答案为:427.2;
N2(g)+3H2(g)的活化能为427.2 kJ/mol,故答案为:427.2;
②催化剂可以降低反应的活化能,增大反应速率,即Ea、Ea1均减小,但反应热不变,则加入铁粉后的能量变化曲线为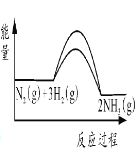 ,故答案为:
,故答案为: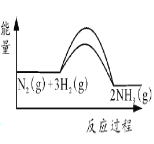 ;
;
(2)将题给反应依次编号为①②③,由盖斯定律可知③×2—②=①,则△H1=2△H3-△H2;用液氧/煤油代替联氨/N2O4的主要原因是液氧/煤油所用原料成本低,无毒,对环境污染小,故答案为:2△H3-△H2;环境污染小;
(3)①A、CO的体积分数不变,说明正反应速率等于逆反应速率,该反应已达平衡状态,故正确;
B、根据质量守恒定律,平衡前后气体质量是不变的,在恒温恒容密闭体系中,整个反应过程混合气体的密度始终是不变的,不可作为判断体系达到平衡状态的判据,故错误;
C、3v(CH4)=v(H2)不能说明正反应速率等于逆反应速率,不可作为判断体系达到平衡状态的判据,故错误;
D、![]() 不再变化,说明在恒温恒容密闭体系中CO和H2的浓度不在变化,该反应已达平衡状态,故正确;
不再变化,说明在恒温恒容密闭体系中CO和H2的浓度不在变化,该反应已达平衡状态,故正确;
AD正确,故答案为:AD;
②设反应i生成一氧化碳的物质的量为x,由题给条件建立如下三段式:
CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
起(mol) a 2a 0 0
变(mol) x x x 3x
平(mol) a—x 2a—x x 3x
CO(g)+ H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起(ol) x 2a—x 0 3x
变(mol) c c c c
平(mol) x—c 2a—x—c c 3x+c
0~tmin内,生成CO2的物质的量为cmol,浓度的变化量为![]() mol/L,则反应速率v(CO2)=
mol/L,则反应速率v(CO2)= ![]() mol/(L·min);由题意可知一氧化碳的物质的量为bmol,则有x—c=b,x=c+b,CH4的转化率为
mol/(L·min);由题意可知一氧化碳的物质的量为bmol,则有x—c=b,x=c+b,CH4的转化率为![]() ×100%;平衡时,c(CO)为
×100%;平衡时,c(CO)为![]() mol/L,c(H2O)为
mol/L,c(H2O)为![]() mol/L,c(CO2)为
mol/L,c(CO2)为![]() mol/L,c(H2O)为
mol/L,c(H2O)为![]() mol/L,反应ⅱ的平衡常数K=
mol/L,反应ⅱ的平衡常数K=![]() =
=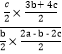 =
=![]() ,故答案为:
,故答案为:![]() mol/(L·min);
mol/(L·min);![]() ×100%;
×100%;![]() ;
;
③反应i为吸热反应,反应ii为放热反应,由图Ⅱ可知T℃时反应达到平衡,升高温度,反应i向正反应方向移动,一氧化碳浓度增大,使二氧化碳浓度有增大的趋势,反应ii向逆反应方向移动,使二氧化碳浓度有减小的趋势,由于温度对c(CO2)的影响大于浓度的影响,所以c(CO2)随温度升高而减小,故答案为:T℃之后,反应②为放热反应,升高温度反应②向逆反应方向移动是影响c(CO2)的主要因素,故c(CO2)减小。


科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,t℃时发生反应:N2(g)+3H2(g)2NH3(g),在体系中,n(N2)随时间的变化如下表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
N2的物质的量(mol) | 0.20 | 0.10 | 0.08 | 0.06 | 0.06 | 0.06 |
(1)上述反应在第4min时,N2的转化率为___;
(2)用H2表示从0~2min内该反应的平均速率v(H2)=___;
(3)t℃时,在4个均为2L密闭容器中不同投料下进行合成氨反应。根据在相同时间内测定的结果,判断该反应进行快慢的顺序为__。(用字母填空,下同);
a.v(NH3)=0.04mol·L-1·min-1 b.v(H2)=0.03mol·L-1·min-1
c.v(N2)=0.03mol·L-1·min-1 d.v(H2)=0.00lmol·L-1·s-1
(4)平衡时容器内气体的压强与起始时比__(填“变大”,“变小”或“相等”下同),混合气体的密度与起始时比___。
(5)将amolN2与bmolH2的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(N2)=n(H2)=2n(NH3),则原混合气体中a:b=___。
(6)下列表述能作为反应达到化学平衡状态的标志是__。
a.反应速率v(N2):v(H2):v(NH3)=1:3:2
b.各组分的物质的量浓度不再改变
c.混合气体的平均相对分子质量不再改变
d.混合气体的密度不变
e.单位时间内生成nmolN2的同时,生成3nmolH2
f.v(N2)消耗=2v(NH3)消耗
g.单位时间内3molH—H键断裂的同时2molN—H键也断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,在三个干燥的烧瓶内分别装有:①干燥且纯净的NH3;②含一半空气的氯化氢气体;③NO2和O2体积比为4:1的混合气体。然后分别做喷泉实验,实验结束后假设三个烧瓶中所得溶液不扩散,则三个烧瓶中所得溶液的物质的量浓度之比为
A.5:5:4B.2:1:2C.1:1:1D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四组实验描述不正确的是
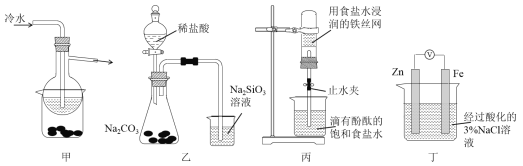
A. 加热甲装置中的烧杯可以分离SiO2和NH4Cl
B. 利用装置乙可证明非金属性强弱:Cl>C>Si
C. 打开丙中的止水夹,一段时间后,可观察到烧杯内溶液上升到试管中
D. 向丁中铁电极区滴入2滴铁氰化钾溶液,一段时间后,烧杯中不会有蓝色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气味。上述物质的转化关系如图所示。下列说法错误的是
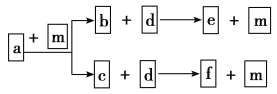
A.简单离子半径:Z<YB.阴离子的还原性:Y>W
C.简单气态氢化物的热稳定性:Y>XD.W、Y、Z形成的化合物含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示原电池,盐桥中装有含琼胶的KCl饱和溶液,相关的叙述中,不正确的是( )
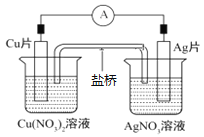
A. 正极的电极反应是Ag++e-=Ag
B. 电子沿导线由Cu片流向Ag片
C. 盐桥中的K+向Cu片移动
D. Cu片上发生氧化反应,Ag片上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由含碘废水制取碘酸钾的一种工艺如下:
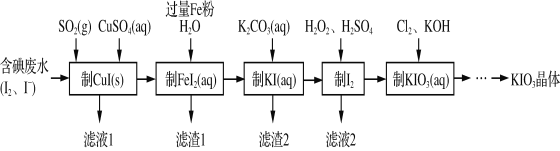
⑴ 写出KIO3在日常生活中的一个重要应用________________________。
⑵ 检验“含碘废水”中是否含有单质I2的常用试剂是________(写试剂名称)。
⑶ 通入SO2的目的是将I2还原为I-,该反应的离子方程式为______________________。
⑷ 工艺中五种物质的制备反应中,不涉及氧化还原反应的步骤是“制________”。
⑸ “制KI(aq)”时,该温度下水的离子积为Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。
为避免0.9 mol·L-1 FeI2溶液中Fe2+水解生成胶状物吸附I-,起始加入K2CO3必须保持溶液的pH不大于______。
⑹ “制KIO3溶液”反应的离子方程式为__________________。
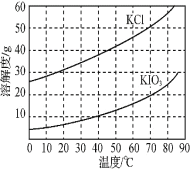
⑺ KCl、KIO3的溶解度曲线如图所示。流程中由“KIO3(aq)”得到KIO3晶体的操作步骤为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次增大的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g·L1;W的质子数是X、Y、Z、M四种元素质子数之和的![]() 。下列说法正确的是
。下列说法正确的是
A.简单离子半径:W+>Y3->X2->M+
B.化合物W2Z2的阴阳离子个数之比为1:1,水溶液显碱性
C.1molWM溶于足量水中完全反应,共转移2mol电子
D.由X、Y、Z、M四种元素形成的化合物中可能只含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列几种有机物:
A.CH4 B.(CH3)2C=CH-CH3 C.C7H16 D.CH2 = CH—CH = CH2E.环戊烷
(1)上述有机物中互为同系物的是_____________,互为同分异构体的是____________。
(2)1molE完全燃烧消耗氧气的物质的量____________________。
(3)A与Cl2反应的类型为_____________;D使溴水褪色的反应类型为___________。
(4)B在催化剂条件下发生加聚反应的化学方程式为 _________________________。
(5)C的同分异构体中含有三个支链的结构简式______________,其系统命名为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com