
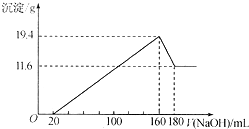
 将一定质量的Mg-Al合金投入到100mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液至过量,生成沉淀质量与加入NaOH溶液的体积关系如图所示. 求:
将一定质量的Mg-Al合金投入到100mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液至过量,生成沉淀质量与加入NaOH溶液的体积关系如图所示. 求:分析 (1)由图可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O,继续滴加NaOH溶液,NaOH与氯化镁、氯化铝反应生成沉淀;
(2)160ml-180ml阶段,随着氢氧化钠的增加,沉淀减少,NaOH与氢氧化铝反应生成偏铝酸钠和水,;
(3)滴加NaOH溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,二者质量之和为19.4g,溶液为氯化钠溶液.再继续滴加NaOH溶液,到沉淀量开始进行,到沉淀量最小时,沉淀为Mg(OH)2,质量为11.6g,则Al(OH)3的质量为19.4g-11.6g=7.8g,由元素守恒可知,n(Al)=n[Al(OH)3],n(Mg)=n[Mg(OH)2],结合离子方程式计算;
(4)160mL时,溶液中的溶质为NaCl,根据原子守恒计算n(HCl),再利用c=$\frac{n}{V}$计算盐酸的物质的量浓度.
解答 解:(1)由图可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O,继续滴加NaOH溶液,NaOH与氯化镁、氯化铝反应生成沉淀,其反应的离子方程式为:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓;
故答案为:Mg2++2OH-=Mg(OH)2↓;Al3++3OH-=Al(OH)3↓;
(2)160ml-180ml阶段,随着氢氧化钠的增加,沉淀减少,NaOH与氢氧化铝反应生成偏铝酸钠和水,其反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O;
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)滴加NaOH溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,二者质量之和为19.4g,溶液为氯化钠溶液.再继续滴加NaOH溶液,到沉淀量开始进行,到沉淀量最小时,沉淀为Mg(OH)2,质量为11.6g,则Al(OH)3的质量为19.4g-11.6g=7.8g,由元素守恒可知,n(Al)=n[Al(OH)3]=$\frac{7.8g}{78g/mol}$=0.1mol,n(Mg)=n[Mg(OH)2]=$\frac{11.6g}{58g/mol}$=0.2mol,原合金与足量的稀硫酸反应离子方程式为:Mg+2H+=Mg2++H2↑、2Al+6H+=2Al3++3H2↑,所以生成氢气为0.2mol+0.15mol=0.35mol,原合金与足量的NaOH溶液反应2Al+2OH-+2H2O=2AlO2-+3H2↑,则生成的氢气为0.15mol,
所以产生气体在同温同压下的体积比为0.35mol:0.15mol=7:3;
故答案为:7:3;
(4)160mL时,溶液中的溶质为NaCl,根据原子守恒得n(NaCl)=n(HCl)=n(NaOH)=0.16L×5mol/L=0.8mol,c(HCl)=$\frac{0.8mol}{0.1L}$=8mol/L,
故答案为:8.
点评 本题考查镁铝化合物性质、混合物的计算,侧重考查分析计算能力,明确各个顶点溶液中物质成分及发生的反应是解本题关键,结合原子守恒解答,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 负极反应式为Mg-2e-=Mg2+ | |
| B. | 正极反应式为Ag++e-=Ag | |
| C. | 电池放电时Cl-由正极向负极迁移 | |
| D. | 负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑ | |
| E. | 能被KCl溶液激活 | |
| F. | 可用于海上应急照明供电 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子. ;Z2Y2与水反应放出气体的离子方程式为Na2O2+2H2O=4Na++4OH-+O2↑.
;Z2Y2与水反应放出气体的离子方程式为Na2O2+2H2O=4Na++4OH-+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
; ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用滤纸称量NaOH固体 | B. | 移液前容量瓶内有水珠 | ||
| C. | 摇匀后,液面低于刻度线 | D. | 定容时,俯视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
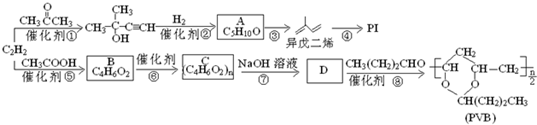

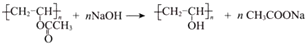 .
.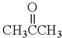 ”改为“乙醛”,经过②、③、④后得到以顺式结构为主的高聚物,则用结构简式表示其顺式结构是
”改为“乙醛”,经过②、③、④后得到以顺式结构为主的高聚物,则用结构简式表示其顺式结构是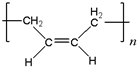 .
.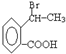 为原料合成
为原料合成 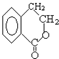 ,下列是合成流程图,在括号内注明反应条件,方框内写出有关物质的结构简式.
,下列是合成流程图,在括号内注明反应条件,方框内写出有关物质的结构简式.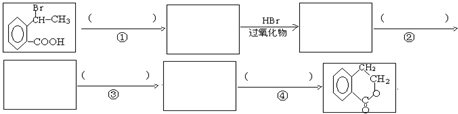
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测液加入试管中, 加入过量的2mol/L盐酸,再滴加适量1mol/LBaCl2溶液 | 有白色沉淀生成, 证明待测液中含SO42-. |
| 步骤② | 另取少量待测液于试管中,加入足量氯水,再加入四氯化碳,震荡,静置后观察颜色 | 下层出现红棕色,则证明 待测液中含有:Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O2与18O2互为同位素 | |
| B. | 16O与18O核外电子排布方式不同 | |
| C. | 通过化学变化可以实现16O2与18O2间的相互转化 | |
| D. | 标准状况下,1.12L16O2和1.12L18O2均含0.1NA个氧原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com