
【题目】NaC1O2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:

回答下列问题:
(l)NaClO2中Cl的化合价为__________。
(2)写出“反应”步骤中生成ClO2的化学方程式__________。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为_____、__。“电解”中阴极反应的主要产物是___________。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。写出此反应的化学方程式________。
(5) “有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2 的氧化能力。NaClO2 的有效氯含量为______。(计算结果保留两位小数)
【答案】 +3价 2NaClO3+SO2+H2SO4=ClO2+2NaHSO4 NaOH溶液 Na2CO3溶液 ![]() (或NaClO2) 2ClO2+2NaOH+H2O2= 2NaClO2+O2↑+2H2O 1.57g
(或NaClO2) 2ClO2+2NaOH+H2O2= 2NaClO2+O2↑+2H2O 1.57g
【解析】(1)在NaClO2中Na为+1价,O为-2价,根据正负化合价的代数和为0,可得Cl的化合价为+3价。
(2)NaClO3和SO2在H2SO4酸化条件下生成ClO2,其中NaClO2是氧化剂,还原产物为NaCl,根据电子守恒和原子守恒,此反应的化学方程式为2NaClO3+SO2+H2SO4=2NaHSO4+ClO2↑。
(3)食盐溶液中混有Mg2+和Ca2+,可利用过量NaOH溶液除去Mg2+,利用过量Na2CO3溶液除去Ca2+,向NaCl溶液加入ClO2,进行电解,阳极发生反应2Cl--2e-=Cl2↑,反应产生Cl2, 阴极发生反应产生NaClO2,可见“电解”中阴极反应的主要产物是NaClO2;
(4)根据图示可知:利用含有过氧化氢的NaOH溶液ClO2气体,产物为NaClO3,则此吸收反应中,氧化剂为ClO2,还原产物为NaClO2,还原剂是H2O2,氧化产物是O2,每1mol的H2O2转移2mol电子,反应方程式是:2NaOH+2ClO2+H2O2=2NaClO2+O2+2H2O,可知氧化剂和还原剂的物质的量之比为2:1,该反应中氧化产物O2。
(5)每1克NaClO2的物质的量为n(NaClO2)=1g÷90.5g/mol, 其获得电子的物质的量是n(e-)=1g÷90.5g/mol ×4=4/90.5mol,1molCl2获得电子的物质的量是2mol,根据电子转移数目相等,可知其相对于氯气的物质的量为n=4/90.5mol÷2= 2/90.5mol,则氯气的质量为2/90.5mol×71g/mol=1. 57g。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】下列关于石油的说法正确的是( )
A.石油与煤炭、天然气、地热能都是化石能源
B.石油主要含有碳、氢两种元素
C.石油属于可再生矿物能源
D.石油分馏的各馏分均是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25 ℃、101 kPa下,0.5 mol辛烷C8H8燃烧生成二氧化碳和液态水时放出2 759 kJ热量。表示上述反应的热化学方程式正确的是( )
A. C8H18(l)+![]() O2(g)===8CO2(g)+9H2O(g) ΔH=-48.40 kJ·mol-1
O2(g)===8CO2(g)+9H2O(g) ΔH=-48.40 kJ·mol-1
B. C8H18(l)+![]() O2(g)===8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
O2(g)===8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
C. C8H18(l)+![]() O2(g)===8CO2(g)+9H2O(l) ΔH=+5 518 kJ·mol-1
O2(g)===8CO2(g)+9H2O(l) ΔH=+5 518 kJ·mol-1
D. 2C8H18(l)+25O2(g)===16CO2(g)+18H2O(l) ΔH=+11 036 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用草酸(H2C2O4)在浓硫酸的作用下分解得一氧化碳,某研究小组利用如图所示装置探究温度对CO还原Fe2O3的影响(固定装置略):

(1)草酸(H2C2O4)在浓硫酸的作用下分解制取一氧化碳的化学方程式为_____________________。
(2)装置C的作用是_______________,加热D装置之前需进行的操作是___________________。
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀硫酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
①甲组步骤1中反应的化学方程式为_________________________。
②甲组步骤3中,溶液变红的离子方程式为______________________。
③乙组得到的黑色粉末是_____________(填化学式)。
④乙组步骤4中,溶液褪色可能的原因及其验证方法为_______________________。
(4)该装置的改进措施除了在E装置后加尾气处理装置外还需_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X(HOOC-CH(OH) -CH2 -COOH)广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂为多。
(1)在一定条件下,有机物X可发生化学反应的类型有(填序号)____。
A.水解反应B.取代反应C.加成反应D.消去反应E.加聚反应F.中和反应
(2)写出X与金属钠发生反应的化学方程式:___________________。
(3)与X互为同分异构体的是(填序号)____。
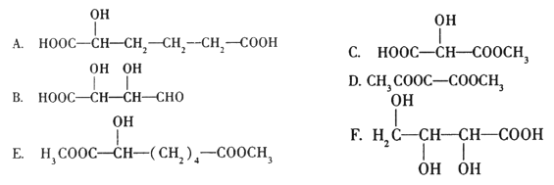
(4)写出X与O2在铜作催化剂、加热的条件下发生反应所得到的可能产物的结构简式:_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2011年,某媒体报道了“皮革奶”事件,不法厂商将皮革下脚料水解后掺入奶粉以提高奶粉中蛋白质的含量。下列说法不正确的是
A.动物皮革的主要成分是蛋白质
B.天然蛋白质水解的最终产物是α—氨基酸
C.皮革鞣制过程中使用的K2Cr2O7会使蛋白质盐析
D.“皮革奶”灼烧时有烧焦羽毛的气味
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增多。其中A、B、C都是能层数为2的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。E的核外电子排布中有6个未成对电子,是同周期中最多的,ECl3能与B、C的氢化物形成六配体的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界。试用相应的元素符号或式子填空:
(1)写出元素的名称 A ___________ E ____________;
(2).A、B、C的第一电离能由小到大的顺序为 _____________________;B的氢化物分子的中心原子采取_______ 杂化;该分子的空间构型为 _______________ 。
(3)化合物AC2与一种由B、C组成的化合物X互为等电子体,则X的化学式为 ____________;完全由B的原子组成的某粒子与AC2也属于等电子体,该粒子的化学式为 ________ ,其空间构型为 ______________ 。
(4)ECl3形成的配合物的化学式为 ____________________________ ;
(5)D的单质在AC2中可以燃烧并一种白色固体和一种黑色固体,该反应的化学方程式为 ________ 。
(6)与E同周期,且最外层电子排布相同的原子的价层电子排布式有______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com