
分析 (1)根据CO反应后生成CO2,碳的价态由+2升高到+4价,化合价升高2,即一个CO转移的电子数为2,CH4反应后生成CO2和水,碳的价态由-4升高到+4价,化合价升高8,即一个CH4转移的电子数为8来分析计算;
(2)根据CO的燃烧热计算,2molCH4完全燃烧生成液态水,所放出的热量,再根据热化学方程式的书写原则进行书写.
解答 解:(1)一个CO转移的电子数为2,一个CH4转移的电子数为8,等体积的CO,CH4转移的电子数之比为1:4,故答案为:1:4;
(2)CO的燃烧热为283kJ/mol.相同条件下,2molCH4完全燃烧生成液态水,所放出的热量为283kJ×6.3=1782.9kJ,故甲烷完全燃烧生成液态水的热化学方程式为:CH4(g)+2O2 (g)=CO2(g)+2H2O(1)△H=-891.45kJ/mol,
故答案为:CH4(g)+2O2 (g)=CO2(g)+2H2O(1)△H=-891.45kJ/mol.
点评 本题考查了氧化还原反应电子转移和热化学方程式的书写,题目难度中等,注意掌握热化学方程式的书写过程.


科目:高中化学 来源: 题型:选择题
| A. | 由于Al2O3熔点比Al高,所以在酒精灯上加热铝箔时,铝熔化但不滴落 | |
| B. | 铁丝不论在空气中还是纯氧中都不会燃烧 | |
| C. | 钠与氧气反应时,产物是由反应条件决定 | |
| D. | 金属单质与非金属单质发生反应时,被氧化的一定是金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
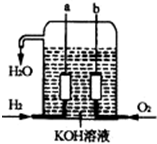 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

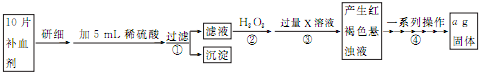

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
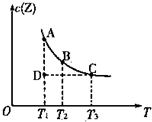 在容积不变的密闭容器中有反应:X(g)+Y(g)?Z(g),若Z(g)的物质的量浓度c(Z)与温度T的关系如图所示(曲线上的任意一点都表示平衡状态).则下列说法不正确的是( )
在容积不变的密闭容器中有反应:X(g)+Y(g)?Z(g),若Z(g)的物质的量浓度c(Z)与温度T的关系如图所示(曲线上的任意一点都表示平衡状态).则下列说法不正确的是( )| A. | A点与B点相比,B点的c(X)大 | B. | A点与C点的化学反应速率:A<C | ||
| C. | 在反应进行到D点时,v正>v逆 | D. | 该反应的正反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 第三周期元素的离子半径从左到右依次减小 | |
| B. | HCl、PCl5、N2、CO2分子中所有原子都满足最外层8电子的结构 | |
| C. | 晶体内可以不存在化学键,也可以同时存在离子键和共价键 | |
| D. | 若某离子化合物X2Y3中X3+和Y2-的电子层结构相同,则X、Y两元素的原子序数之差可能是5、15或29 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | A | B | C | D |
| n(CO2)(mo1) | 1 | 2 | 3 | 4 |
| n(沉淀)(mo1) | 1 | 1 | 2 | 2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol•L-1 | B. | 1.6mol•L-1 | C. | 0.8mol•L-1 | D. | 0.4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氢气作为一种清洁能源,必须解决它的储存问题,C60(结构见图)可用作储氢材料,已知C60中每个碳原子均达到8电子稳定结构.
氢气作为一种清洁能源,必须解决它的储存问题,C60(结构见图)可用作储氢材料,已知C60中每个碳原子均达到8电子稳定结构.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com