
| A. | NH4Cl中N元素被还原 | |
| B. | NaNO2是还原剂 | |
| C. | 生成1 mol N2时转移6 mol电子 | |
| D. | 氧化剂和还原剂的物质的量之比是1:1 |
分析 用NH4Cl和NaNO2反应制取N2,NaNO2中N元素的化合价由+3价降低为0,NH4Cl中N元素的化合价由-3价升高为0,依据原子个数守恒、得失电子守恒反应方程式为:NaNO2+NH4Cl=NaCl+N2↑+2H2O,据此解答.
解答 解:A.用NH4Cl和NaNO2反应制取N2,反应中NH4Cl中的-3价N化合价升高,被氧化,故A错误;
B.用NH4Cl和NaNO2反应制取N2,反应中NaNO2中+3价N化合价降低,被还原,所以在NaNO2反应中做氧化剂,故B错误;
C.依据方程式:NaNO2+NH4Cl=NaCl+N2↑+2H2O,每生成1mol N2时,由化合价的变化可知,转移电子的物质的量为3mol,故C错误;
D.NaNO2中N元素的化合价由+3价降低为0,为氧化剂,NH4Cl中N元素的化合价由-3价升高为0,为还原剂,则氧化剂和还原剂的物质的量之比是1:1,故D正确;
故选:D.
点评 本题考查氧化还原反应和电子式,把握氧化还原反应元素的化合价变化为解答的关键,注意转移电子数目的计算,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
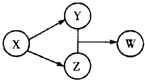 X、Y、Z、W四种物质的转化关系如图所示(部分反应物和产物已经省略).下列组合中不符合该关系的是
X、Y、Z、W四种物质的转化关系如图所示(部分反应物和产物已经省略).下列组合中不符合该关系的是 | A | B | C | D | |
| X | HCl | Na2O2 | Na2CO3 | Al2O3 |
| Y | FeCl2 | NaOH | CO2 | AlCl3 |
| Z | Cl2 | Na2CO3 | CaCO3 | NaAlO2 |
| W | FeCl3 | NaHCO3 | Ca(HCO3)2 | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)+c(NH3•H2O)=0.1 mol/L | B. | 2c(Fe2+)+c(NH4+)=2c(SO42-) | ||
| C. | c(NH4+):c(Fe2+):c(SO42-)=2:1:2 | D. | c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3晶体(NaCl),蒸馏水,结晶 | |
| B. | CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气 | |
| C. | HNO3溶液(H2SO4),适量BaCl2溶液,过滤 | |
| D. | C2H5OH(CH3COOH),加足量CaO,蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以氨作为燃料的固体氧化物(含有02-)燃料电池,具有全固态结构、能量效率高、无污染等特点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很好的氢源载体.其工作原理如图所示:
以氨作为燃料的固体氧化物(含有02-)燃料电池,具有全固态结构、能量效率高、无污染等特点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很好的氢源载体.其工作原理如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com