
在100 ℃时,将0.100 mol N2O4气体充入1 L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到如表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol·L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
(1)该反应的平衡常数表达式为________;从表中分析:
c1________c2,c3________c4(填“>”、“<”或“=”)。
(2)在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为________mol·L-1·s-1。
(3)达平衡后下列条件的改变可使NO2气体浓度增大的是________(填字母序号)。
A.扩大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He
(4)若在相同条件下,起始时只充入0.080 mol NO2气体,则达到平衡时NO2气体的转化率为________。
解析 (1)本题的反应方程式为N2O4(g)2NO2(g),由表中数据可计算出c1=0.070,c2=0.100,根据60 s和80 s时c(NO2)相等可确定在60 s时反应已达平衡状态,则有c3=c4。(2)由表中数据知,从反应开始直至达到化学平衡,v(NO2)=0.002 mol·(L·s)-1,则v(N2O4)=0.001 mol·(L·s)-1。(3)选项A和C中改变条件后,c(NO2)减小,选项D中改变条件后,c(NO2)保持不变。(4)在题设条件下反应N2O4(g)2NO2(g)的平衡常数K=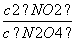 =
=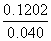 =0.36。现充入NO2气体0.080 mol,相当于0.040 mol N2O4,设达平衡时N2O4的浓度变化了x mol·L-1,则有K=
=0.36。现充入NO2气体0.080 mol,相当于0.040 mol N2O4,设达平衡时N2O4的浓度变化了x mol·L-1,则有K=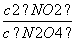 =
=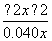 =0.36,解得x=0.030,即达到平衡时混合气体中有0.06 mol NO2和0.01 mol N2O4,所以NO2的转化率为25%。
=0.36,解得x=0.030,即达到平衡时混合气体中有0.06 mol NO2和0.01 mol N2O4,所以NO2的转化率为25%。
答案 (1)K=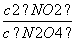 < = (2)0.001 (3)B (4)25%
< = (2)0.001 (3)B (4)25%


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
将0.48 g Mg粉加入到500 mL 0.1 mol·L-1的硝酸中恰好完全反应,则还原产物可能是 ( )。
A.NO2 B.NO
C.N2O3 D.NH
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成,取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现用下图所示装置进行实验 (铁架台、铁夹、酒精灯等未画出)。请回答有关问题:
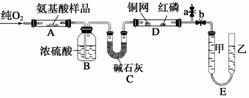
(1)实验开始时,首先打开止水夹a,关闭止水夹b,通入一段时间的氧气,这样做的目的是____________________________,之后关闭止水夹a。
(2)由装置B、C可分别确定待测氨基酸中含有的________和________的质量。
(3)E装置的作用是测量________的体积,并由此确定待测氨基酸中含有的____________的质量,为了较准确地测量该气体的体积,在读反应前后甲管液面的读数求其差值的过程中,应注意________(填序号)。
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时,立刻读数
c.读数时应上下移动乙管,使甲、乙管液面相平
d.读数时不一定使甲、乙两管液面相平
(4)实验中测定的哪一数据可能不准确
________________________________________________________________________,
其理由是
________________________________________________________________________。
(5)严格地说,按上述方案只能确定氨基酸的________________。
若要确定此氨基酸的分子式,还要测定该氨基酸的____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应在任何温度下均能自发进行的是 ( )。
A.2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1
B.Ag(s)+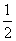 Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C.HgO(s)===Hg(l)+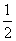 O2(g) ΔH=+91 kJ·mol-1
O2(g) ΔH=+91 kJ·mol-1
D.H2O2(l)===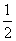 O2(g)+H2O(l) ΔH=-98 kJ·mol-1
O2(g)+H2O(l) ΔH=-98 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:CO(g)+H2O(g)CO2(g)+H2(g) ΔH=-41 kJ
·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
| CO | H2O | CO2 | H2 | ||
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
| ② | 0 | 0 | 1 | 4 | 热量变化:Q |
下列说法中,不正确的是 ( )。
A.容器①中反应达到平衡时,CO的转化率为80%
B.容器①中CO的转化率等于容器②中CO2的转化率
C.平衡时,两容器中CO2的浓度相等
D.容器①中CO反应速率等于H2O的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
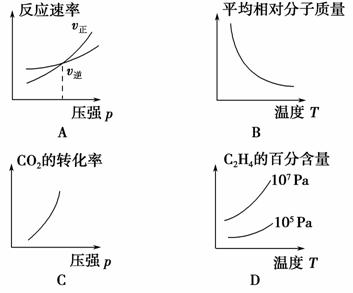
科学家采用“组合转化”技术,将CO2在一定条件下转化为重要的化工原料乙烯:2CO2(g)+6H2(g)C2H4(g)+4H2O(g),正反应为吸热反应,该反应达到平衡后,改变横坐标表示的反应条件,下列图示错误的是 ( )。
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)B(g)+C(g)在容积为1.0 L的密闭容器中进行,A的初始浓度为0.050 mol·L-1。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
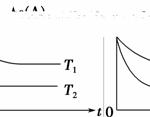
(1)上述反应的温度T1________T2,平衡常数K(T1)________K(T2)。(填“大于”、“小于”或“等于”)
(2)若温度T2时,5 min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为_______________________________________。
②反应的平衡常数K=________________________________________。
③反应在0~5 min区间的平均反应速率v(A)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
分别向1 L 0.5 mol·L-1的Ba(OH)2溶液中加入①浓硫酸、②稀硫酸、③稀硝酸,恰好完全反应时的热效应分别为ΔH1、ΔH2、ΔH3,下列关系中正确的是 ( )。
A.ΔH1>ΔH2>ΔH3 B.ΔH1<ΔH2<ΔH3
C.ΔH1>ΔH2=ΔH3 D.ΔH1=ΔH2<ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
乙酸橙花酯是一种食用香料,其结构简式如右图所示,关于该有机物的下列叙述中正确的是
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③能发生加成反应,但不能发生取代反应
④它的同分异构体中可能有芳香族化合物,且属
于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol
A.①②③ B.①②⑤ C.①②⑤⑥ D.①②④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com