
| A. | NaHCO3能中和胃酸,对胃壁不产生强烈的刺激或腐蚀作用,可用于治疗胃酸过多症,但不适合胃溃疡病人 | |
| B. | NaHCO3能中和面粉发酵后产生的酸,并且产生二氧化碳气体,可用于做馒头 | |
| C. | Na2CO3溶液中混有NaHCO3时,用给溶液加热的方法不能除去 | |
| D. | 往Na2CO3饱和溶液中通入CO2气体,可获得NaHCO3沉淀,由此可说明Na2CO3的溶解度比NaHCO3大 |
分析 A、小苏打与胃酸中的盐酸反应生成氯化钠、水和二氧化碳气体,患胃溃疡的病人,为防止胃壁穿孔,不能服用小苏打来治疗;
B、NaHCO3与酸反应生成二氧化碳气体;
C、Na2CO3溶液中混有NaHCO3时,加入适量的氢氧化钠,使碳酸氢钠转化为碳酸钠;
D、Na2CO3比NaHCO3易溶于水.
解答 解:A.小苏打与胃酸中的盐酸反应生成氯化钠、水和二氧化碳气体,反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑,患胃溃疡的病人,为防止胃壁穿孔,不能服用小苏打来治疗,因为反应产生的二氧化碳气体会造成胃部气胀,易造成胃穿孔,故A正确;
B、NaHCO3与酸反应生成二氧化碳气体,遇热膨胀而形成小孔,使得馒头或面包暄软多空,故B正确;
C、Na2CO3溶液中混有NaHCO3时,加入适量的氢氧化钠,使碳酸氢钠转化为碳酸钠,而不是加热,故C正确;
D、Na2CO3比NaHCO3易溶于水,在饱和Na2CO3溶液中通入过量二氧化碳气体可得到NaHCO3沉淀,则往两者饱和溶液中通入CO2,最终会形成澄清溶液的是NaHCO3,故D错误;
故选D.
点评 本题考查Na2CO3和NaHCO3性质的异同,侧重于学生的分析能力的考查,为高频考点,注意把握Na2CO3和NaHCO3性质,注重基础知识的积累,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | (CH3)2C═O+HCN→(CH3)2C(OH)CN 属于加成反应 | |
| B. | CH3OH、CH2OHCH2OH、CH2OHCHOHCH2OH是同系物 | |
| C. |  属于取代反应 属于取代反应 | |
| D. | 1molCH3CH3与Cl2完全反应生成六氯乙烷时,消耗Cl26mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
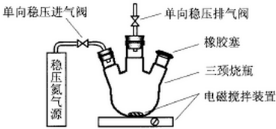 水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg/L,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg/L.某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO.
水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg/L,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg/L.某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
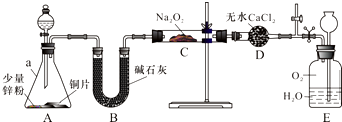
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器中CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1 | |
| B. | v正(CO2)=3v逆(H2) | |
| C. | 容器内混合气体平均相对分子质量保持不变 | |
| D. | 容器中CO2、H2、CH3OH、H2O的物质的量浓度都相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室配制银氨溶液时,应将2%硝酸银滴入2mL 2%的氨水中 | |
| B. | 除去乙酸乙酯中的部分乙醇和乙酸可用饱和Na2CO3溶液 | |
| C. | 卤代烃和酯的水解都可用浓硫酸作催化剂 | |
| D. | 在卤代烃水解后的溶液中加入硝酸银溶液观察沉淀现象就可确定其中的卤素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌 | |
| B. | 含I-的滤液中加入稀硫酸和双氧水后,碘元素发生还原反应 | |
| C. | 在碘水中加入几滴淀粉溶液,溶液出现蓝色沉淀 | |
| D. | 碘水加入CCl4得到I2的CCl4溶液,该操作为萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚氯乙烯与乙烯性质相似,可使溴水褪色 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | C5H11Cl有8种同分异构体 | |
| D. | 相同条件下,熔沸点:正丁烷<异丁烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com