
| 阳离子 | Na+、Al3+、Ba2+、H+、NH4+ |
| 阴离子 | SO42-、OH-、CO32-、Cl- |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 如图所示装置有多种用途,请回答下列问题:
如图所示装置有多种用途,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2(SO4)3 |
| B、NaOH |
| C、BaCl2 |
| D、FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分散系只包括溶液和胶体 |
| B、丁达尔效应是光线通过胶体时能看到光亮的“通路”的现象 |
| C、单位物质的量的物质所具有的质量叫摩尔质量,摩尔质量与l mol物质的质量完全相同 |
| D、物质失电子的反应为还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应速率 |
| B、混合气体的密度保持不变 |
| C、混合气体的颜色保持不变 |
| D、混合气体的体积保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
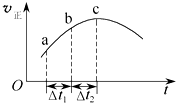 向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )| A、反应物的总能量低于生成物的总能量 |
| B、反应物浓度:a点小于b点 |
| C、△t1=△t2时,SO2的转化率:a~b段小于b~c段 |
| D、反应在c点达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com