
| 1 |
| 4 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
| M |
| 2ρd3 |
| M |
| 2ρd3 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、①②⑤⑥ | B、②③④⑦. |
| C、①③⑤⑦ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热的纯碱去油污效果好,因为加热可使CO32-的水解程度增大,溶液碱性增强,去污能力增强 | ||||
| B、铁在潮湿的环境下生锈与盐类水解有关 | ||||
| C、将Al2(SO4)3溶液加热、蒸干、灼烧,可得到固体Al2(SO4)3 | ||||
D、将FeCl3饱和溶液滴入沸水中制胶体,离子方程式为Fe3++3H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铝是电解质,可用电解熔融的氯化铝制取铝 |
| B、可以用加热使蛋白质变性的方法分离提纯蛋白质 |
| C、利用纯天然纤维,禁止使用化学合成材料符合“绿色化学”思想 |
| D、“酸雨”主要是由于大气中含有较高浓度硫的氧化物和氮的氧化物造成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
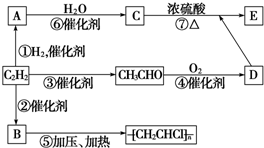
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol?L-1 |
| B、4mol?L-1 |
| C、6mol?L-1 |
| D、8mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com