
下列说法或实验操作正确的是
A. 决定反应速率的主要因素有浓度、压强、温度
B. 容量瓶、量筒个滴定管上都标有使用温度,容量瓶无“0”刻度,量筒、滴定管有“0”刻度;实验时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗
C. 为实验安全,金属钠切割下来的表层物质反应放回原试剂瓶,不能再研磨氯酸钾或硝酸钾
D. 皂化反应结束后的混合液中加入饱和食盐水,再通过分液操作分离出硬质酸钠
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题
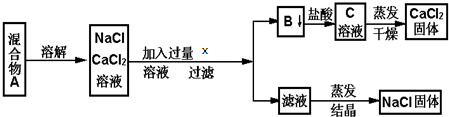
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期期中化学试卷(解析版) 题型:填空题
氮及其化合物在工农业生产生活中应用广泛,请解决下列问题。
(1)硫酸铜溶液时白磷引起中毒的一种解毒剂:
P4+CuSO4+H2O Cu3P+H3PO4+H2SO4,若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为 。
Cu3P+H3PO4+H2SO4,若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为 。
(2)氮的化合物合成、应用及氮的固定一直是科学研究的热点。以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO (NH2)2(s)+H2O(g);ΔH=a kJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol-1
则a为 。
(3)右图表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式 。生产中可分离出的物质A的化学式为 。

(4)常温下,向0.1mol/L氨水中加入少许N2O5,使溶液中c(NH3·H2O):c(NH4+)=5:9,此时溶液的pH= .(25℃时,NH3·H2O的电离常数Kb=1.8×10-5)
(5)SiO2溶于氢氟酸后生成一种极强的二元酸和水,经分析该酸由3种元素组成,其中氟元素的质量分数为79.17%。请写出SiO2溶于氢氟酸的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期期中化学试卷(解析版) 题型:选择题
NA表示阿伏伽德罗常数,下列说法正确的是
A.标准状况下,22.4L HF中含有氟原子数目为NA
B.0.1mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H+)
C.1mol 如图物质与浓溴水反应时通常最多消耗Br2为6mol

D.12g石墨烯(单层石墨)中含有六元环的个数为0.5NA
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期期中化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺都符合绿色化学的思想
B.氨基酸是人体必需的营养物质,其晶体主要以内盐形式存在,调节溶液的pH可改变它的溶解度
C.石油裂解、煤的气化、橡胶老化、海水制镁、纯碱晶体风化、纤维素制火棉等过程中都包含化学变化
D.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物”,PM2.5在空气中只形成气溶胶
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.漂白粉露置在空气中:ClO-+CO2+H2O=HClO+HCO3-
B.用过量氨水吸收二氧化硫:SO2+NH3·H2O=HSO3-+NH4+
C.少量CO2通入苯酚钠溶液:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
D.磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+8H+=Fe2++2Fe3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com