
【题目】高铁酸钾(K2FeO4)既能消毒杀菌,又能净水,是一种理想的水处理剂。工业 上制备高铁酸钾的一种工艺流程如下:
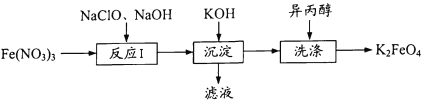
(1)K2FeO4中铁元素的化合价为 ____。
(2) “反应I”中参加反应的Fe3+与ClO-的物质的量之比为2 : 3,则滤液中含氯物质的化学式为____。写出“反应I”的离子方程式:_____。
(3)K2FeO4在水中发生反应:4K2FeO4+ 10H2O = 4Fe(OH)3 (胶体)+8KOH+3O2 ↑。高铁酸钾能消毒杀菌是因为____;它能净水是因为_____。
【答案】+6 NaCl 2Fe3+ + 3ClO-+10OH-= 2FeO42-+3Cl-+5H2O 具有强氧化性 生成的Fe(OH)3胶体具有吸附作用,可以吸附水中的杂质
【解析】
有流程可知Fe(NO3)3在碱性条件下与NaClO发生氧化还原反应生成硝酸钠、高铁酸钠、氯化钠和水,向反应所得溶液中加入氢氧化钾,析出溶解度较小的K2FeO4,用异丙醇洗涤得到K2FeO4。
(1)由化合价代数和为零可知K2FeO4中铁元素的化合价为+6价,故答案为:+6;
(2)设滤液中含氯物质的化合价为x,由得失电子数目守恒可得(6—3)×2=(1—x)×3,解得x=—1,则滤液中含氯物质为NaCl,由此可知Fe(NO3)3在碱性条件下与NaClO发生氧化还原反应生成硝酸钠、高铁酸钠、氯化钠和水,反应的离子方程式为2Fe3+ + 3ClO-+10OH-= 2FeO42-+3Cl-+5H2O,故答案为:NaCl;2Fe3+ + 3ClO-+10OH-= 2FeO42-+3Cl-+5H2O;
(3)高铁酸钾具有强氧化性,能起到杀菌消毒的作用,杀菌消毒过程中高铁酸钾被还原生成的Fe(OH)3胶体具有吸附作用,可以吸附水中的杂质,可以达到净水的作用,故答案为:具有强氧化性;生成的Fe(OH)3胶体具有吸附作用,可以吸附水中的杂质。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤。图示装置和原理不合理的是
A.制取氨气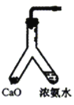 B.制取NaHCO3
B.制取NaHCO3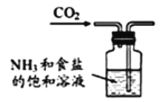
C.分离NaHCO3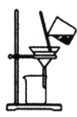 D.干燥NaHCO3
D.干燥NaHCO3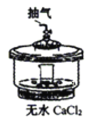
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O="O " dkJ·mol—1。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A. (6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 B. (4c+12b-4a-5d)kJ·mol—1
C. (4a+5d-4c-12b)kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4LNO和22.4LO2混合后的分子总数为2NA
B.0.1molL-1的氨水中,溶液中各微粒的物质的量存在以下关系:n(![]() )+n(NH3)+n(NHH2O)=0.1mol
)+n(NH3)+n(NHH2O)=0.1mol
C.已知氢气的热值为143kJg-1,则氢气充分燃烧的热化学方程式可表示为:H2(g)+![]() O2(g)=H2O(l) ΔH=-286kJmol1
O2(g)=H2O(l) ΔH=-286kJmol1
D.用酸性高锰酸钾溶液检验火柴头燃烧产生的SO2气体,当10mL0.1molL-1的酸性高锰酸钾溶液刚好褪色时,转移的电子总数为0.0025NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在800℃时,2L密闭容器内发生反应:2NO(g)+O2(g)2NO2(g),反应体系中,一氧化氮的物质的量随时间的变化如表所示:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如图表示NO2的物质的量浓度变化的曲线是________。
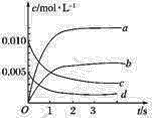
(2)用O2表示从0~2 s内该反应的平均速率v=__________。
(3)能说明该反应已达到平衡状态的是________。
A.v(NO2)=2v(O2)
B.容器内压强保持不变
C.容器内气体质量不变
D.容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.化合物甲和化合物乙的混合粉末是汽车安全气囊中存放的化学物质,经组成分析,确定该混合粉末仅含 Na、Fe、N、O 四种元素。为研究安全气囊工作的化学原理,进行以下实验操作:
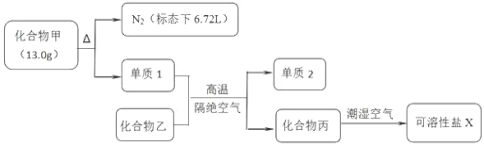
请回答下列问题:
(1)工业上冶炼单质2的化学方程式为 ________;
(2)若化合物丙在空气中转化为碳酸氢盐,则反应的化学方程式为 ________;
(3)化合物甲可用下列方法制备:30℃时,将水合肼(N2H4H2O)、亚硝酸甲酯(CH3ONO)、NaOH 混合,充分反应后先回收得到 CH3OH,母液降温结晶,过滤得到化合物甲。写出用该法制备化合物甲的化学反应方程式 ________。
II.晶体硅是一种重要的非金属材料。实验室用 SiHCl3 与过量 H2 反应制备纯硅的装置如下(热源及夹持装置略)。制备纯硅的主要反应为:SiHCl3+H2 = Si(纯)+3HCl
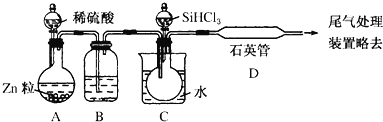
已知①SiHCl3 沸点 33.0℃,上述反应在 1000~1100℃进行;②SiHCl3 能与 H2O 强烈反应,在空气中易自燃。
请回答下列问题:
(1)下列说法不正确的是___________;
A.装置B中的溶液可以是浓硫酸
B.装置C中的烧瓶需要加热,其目的是使滴入烧瓶中的 SiHCl3 气化
C.装置D中观察到的现象是有固体物质生成
D.装置D可以采用普通玻璃管代替石英管
E.为保证制备纯硅实验的成功,关键的操作步骤有检查实验装置的气密性,控制好反应温度以及排尽装置中的空气、干燥气体
F.尾气处理装置中可以将导管直接插入盛有NaOH 溶液的烧杯中
(2)为检验某粗硅中存在的铁元素,可采取的实验操作方法是__________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组采用电解锰粉(主要成分为Mn和少量含Fe、Ni、Pb、P、Si等元素的单质或其化合物)为原料制备高纯氯化锰。
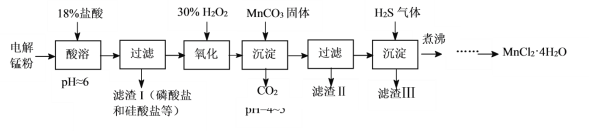
已知:①Mn是一种比Fe活泼的金属。
②H2S气体具有较强的还原性,如:H2S+H2O2=S↓+2H2O。
③相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)
Fe3+ | Fe2+ | Mn2+ | Ni2+ | Pb2+ | |
开始沉淀的pH | 1.1 | 5.8 | 8.6 | 6.7 | 8.0 |
沉淀完全的pH | 3.2 | 8.8 | 10.1 | 9.2 | 8.8 |
(1)酸溶时盐酸要缓慢滴加的原因是___。
(2)加入MnCO3固体时发生反应的离子方程式为___。MnCO3固体也可用下列物质代替___。(填写编号)
A.MnO B.MnSO4 C.Mn(OH)2 D.MnCl2
(3)通入H2S气体可使Pb2+、Ni2+生成硫化物沉淀,如:H2S(aq)+Pb2+(aq)![]() PbS(s)+2H+(aq),该反应的平衡常数K=___[用Ka1(H2S)、Ka2(H2S)及Ksp(PbS)表示]。
PbS(s)+2H+(aq),该反应的平衡常数K=___[用Ka1(H2S)、Ka2(H2S)及Ksp(PbS)表示]。
(4)煮沸的目的是___。
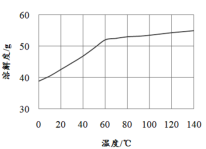
(5)已知MnCl2·4H2O在106℃时失去一分子结晶水,198℃失去全部结晶水。请补充完整由煮沸后的滤液获得高纯(>99.99%)MnCl2·4H2O晶体(MnCl2的溶解度曲线如图所示)的实验方案:将煮沸后的滤液冷却至室温,___(实验中须使用的试剂是:30%H2O2)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2+B2===2AB的能量变化如图所示,则下列说法正确的是( )
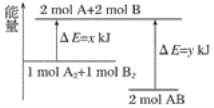
A. 该反应是吸收能量的反应
B. 1molA—A键和1molB—B键断裂能放出xkJ的能量
C. 2molA—B键断裂需要吸收ykJ的能量
D. 2molAB的总能量高于1molA2和1molB2的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4℃时向100mL水中溶解了22.4LHCl气体(标准状况下测得)后形成的溶液。下列说法中正确的是( )
A. 该溶液物质的量浓度为10mol·L-1
B. 该溶液物质的量浓度因溶液的密度未知而无法求得
C. 该溶液中溶质的质量分数因溶液的密度未知而无法求得
D. 所得溶液的体积为22.5L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com