
| A. | 根据②③④可确定一定含有NO2-、CO32-、Cl-三种阴离子 | |
| B. | 由②中的实验现象可推测一定含有NO2- | |
| C. | 不能确定是否一定含有NO3- | |
| D. | 由④即可确定一定不存在SO42-、SO32- |
分析 ④加足量BaCl2溶液,产生白色沉淀,该沉淀完全溶于稀硝酸且放出气体,硫酸钡不溶于稀硝酸,所以一定不存在SO42-、SO32-,题中能够生成的沉淀溶于稀硝酸且放出气体的离子只有CO32-;
②加入盐酸,产生有色刺激性气体,生成有色气体为二氧化氮,说明发生了氧化还原反应,可能存在I-、NO2-、NO3-;
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体,由于氯化银为白色沉淀、碘化银为黄色沉淀,则溶液中一定存在Cl-,一定不存在I-,有色气体为二氧化氮,溶液中一定存在NO2-,可能存在NO3-;
①用pH计测得溶液pH大于7,进一步验证溶液中存在碳酸根离子;
根据以上分析进行解答.
解答 解:由实验④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色,可知白色沉淀是BaCO3,气体是CO2,所以可以排除SO42-和SO32-;
实验③可以证明含有Cl-,一定不存在I-,由于放出有色刺激性气体,所以只能是亚硝酸的自身分解,反应的方程式为:2HNO2═H2O+NO↑+NO2↑,不能确定是否含有NO3-,
A.根据以上分析可知,由②③④可确定一定含有NO2-、CO32-、Cl-三种阴离子,故A正确;
B.②加入盐酸,产生有色刺激性气体,可能存在硝酸根离子和碘离子,二者反应能够生成一氧化氮,一氧化氮与空气中的氧气生成有色的刺激性气体二氧化氮,所以不一定存在NO2-,故B错误;
C.根据分析可知,不能确定是否一定含有NO3-,故C正确;
D.根据④可知,一定不存在SO42-、SO32-,一定存在碳酸根离子,故D正确;
故选B.
点评 本题考查了常见离子的检验,题目难度中等,注意掌握常见离子的性质及检验方法,推断离子的存在时,一定注意排除干扰离子,做到推断的严密性、科学性.


科目:高中化学 来源: 题型:选择题
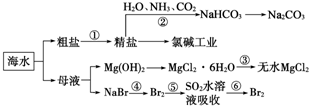
| A. | 过程①中除去粗盐中的SO${\;}_{4}^{2-}$、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 过程②中应先通入NH3再通入CO2气体 | |
| C. | 过程③中结晶出的MgCl2•6H2O要在HCl氛围中加热脱水制得无水MgCl2 | |
| D. | 从第⑤~⑥步的目的是浓缩、富集溴单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I2发生还原反应 | |
| B. | 氧化剂为I2 | |
| C. | 还原剂为KClO3 | |
| D. | 反应中KClO3被还原为Cl2,I2被氧化为KIO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (或
(或
 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液 | |
| B. | 碳酸钠溶液显碱性,可用热的纯碱溶液除去金属器件表面矿物油 | |
| C. | 氮气化学性质通常不活泼,可将炽热的镁粉可放在氮气中冷却 | |
| D. | 钾(K)一般不用电解法制备,工业上可用Na与熔融KCl反应制K |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Ca2+、Cl-、CH3COO- | B. | NH4+、Ca2+、HCO3-、SO42- | ||
| C. | K+、Ba2+、OH-、Cl- | D. | Cu2+、H+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com