

| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
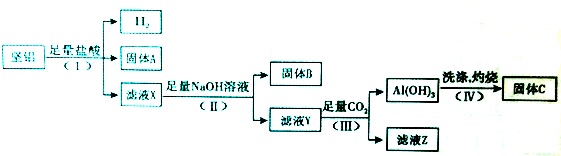
分析 (1)电解饱和食盐水产物是氢氧化钠、氢气和氯气,氯气还可以和氢氧化钠之间反应得到氯化钠、次氯酸钠和水;
(2)①根据物质的转化情况,电解池的左池是可以得到氢氧化钠来判断饱和NaCl溶液的进入情况;
②在燃料电池中,所以通入空气的极是正极,氧气发生得电子的还原反应,通入燃料的极是负极,氢氧燃料电池最后产生的是水,能将电解质稀释,据此回答判断;
(3)a.根据氯气和水的反应平衡移动的影响因素来回答;
b.盐的水解都对水的电离起到促进作用,水解规律:越弱越水解;
c.酸的酸性越强,则pH越小,酸的电离平衡常数可以反映酸的强弱;
d.根据亚硫酸氢钠溶液显示酸性,则阴离子的电离程度大于其水解程度,据此回答判断.
解答 解:(1)电解饱和食盐水产物是氢氧化钠、氢气和氯气,氯气还可以和氢氧化钠之间反应得到氯化钠、次氯酸钠和水,整个过程发生的反应是:Cl-+H2O$\frac{\underline{\;电解\;}}{\;}$ClO-+H2↑,故答案为:Cl-+H2O$\frac{\underline{\;电解\;}}{\;}$ClO-+H2↑;
(2)①根据物质的转化情况,电解池的左池是电解食盐水得到的氢氧化钠,所以经精制的饱和NaCl溶液应从图中电解池的左池进入,
故答案为:左;
②在燃料电池中,氧气作正极,所以通入空气的极是正极,电极反应式为:O2+4e-+2H2O=4OH-,通入燃料的极是负极,即产生Y的极是阴极,所产生的是氢气,在X处产生的是氯气,氢氧燃料电池最后产生的是水,所以a%大于b%,
故答案为:Cl2;O2+4e-+2H2O=4OH-;B;
(3)a.向氯水中加入NaHCO3,可以和盐酸之间反应,促使氯气和水的反应平衡正向移动,增大氯水中次氯酸的浓度,故a正确;
b.四种溶液中,盐中酸根离子水解程度越大,则水的电离程度越大,碱性越强,水解程度越大,即水的电离程度最大的是Na2CO3,故b错误;
c.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,酸性顺序是:H2SO3>H2CO3>HClO,pH最大的是HClO,故c错误;
d.亚硫酸氢钠溶液显示酸性,则阴离子的电离程度大于其水解程度,则NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故d错误.
故答案为:bcd.
点评 本题考查学生电解池的工作原理以及溶液中的电离平衡和水解平衡的应用知识,属于综合知识的考查,综合性强,难度中等,侧重于考查学生的分析能力和对基础知识的综合应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 镁、干冰、硫酸、纯碱、食盐 | B. | 碘酒、冰、盐酸、烧碱、硫酸钡 | ||
| C. | 氢气、氧化钠、硝酸、烧碱、氯化铜 | D. | 铁、氧化铜、醋酸、石灰水、硝酸钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)=2H2O(l);△H=Q1 2H2(g)+O2(g)=2H2O(g);△H=Q2 | |
| B. | S(g)+O2(g)=SO2(g);△H=Q1 S(s)+O2(g)=SO2(g)△H=Q2 | |
| C. | C(s)+0.5O2(g)=CO(g);△H=Q1 C(s)+O2(g)=CO2(g);△H=Q2 | |
| D. | H2(g)+Cl2(g)=2HCl(g);△H=Q1 0.5H2(g)+0.5 Cl2(g)=HCl(g);△H=Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸滴在石灰石上:CO32-+2H+═H2O+CO2↑ | |
| B. | 少量CO2通入氢氧化钠溶液中:CO2+2OH-═CO32-+H2O | |
| C. | NaOH溶液和NaHSO4溶液反应:HSO4-+OH-═SO42-+H2O | |
| D. | 稀H2SO4滴在铜片上:Cu+2H+═Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入FeCl3溶液显紫色,说明存在酚羟基 | |
| B. | 加入金属钠能放出氢气,说明存在羧基 | |
| C. | 能使酸性高锰酸钾溶液褪色,说明存在碳碳双键 | |
| D. | 在2mL 2%的CuSO4溶液中加入10%的NaOH溶液4~5滴配制成氢氧化铜悬浊液,用以检验醛基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
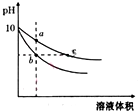 常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列说法正确的是( )
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列说法正确的是( )| A. | b、c两点溶液的导电能力相同 | |
| B. | 稀释之前,两溶液导电能力相同 | |
| C. | a、b、c三点溶液中水的电离程度c>a>b | |
| D. | 用相同浓度的盐酸分别与等体积的b、c处溶液反应,消耗盐酸体积Vc>Vb |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com