
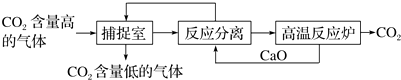
分析 ①“反应分离”中发生的反应有:氧化钙溶于水生成氢氧化钙,然后氢氧化钙与碳酸钠反应生成白色沉淀碳酸钙和氢氧化钠,所以通过过滤可以将其分离开来;
②若经过反应分离得到固体沉淀质量为1000g为二氧化碳,结合碳元素守恒计算;
③“反应分离”发生反应可知氢氧化钠参与反应过程,最后又生成.
解答 解:①“反应分离”内CaO和水反应生成氢氧化钙,其反应方程式为:CaO+H2O=Ca(OH)2;然后氢氧化钙与碳酸钠发生复分解反应反应生成白色沉淀碳酸钙和氢氧化钠,其反应方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,
故答案为:CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
②若经过反应分离得到固体沉淀为碳酸钙质量为1000g,物质的量=$\frac{1000g}{100g/mol}$=10mol,碳元素守恒则理论上经过高温反应炉出来的CO2质量=10mol×44g/mol=440g,
故答案为:440;
③氢氧化钙与碳酸钠发生复分解反应反应生成白色沉淀碳酸钙和氢氧化钠,Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,该生产过程中,CaO和Y溶液均为可以循环使用的物质,则Y溶液的溶质是氢氧化钠,
故答案为:NaOH.
点评 本题属于信息题的考查,考查了化学方程式的书写和流程图的分析,注重对学生解读解能力的考查,有利于培养学生的探究能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.3 | B. | 9.7 | C. | 10.3 | D. | 10.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
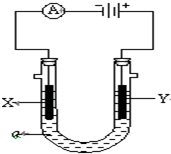 电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “西气东输”中的“气”主要成分是甲烷 | |
| B. | 乙烯的结构简式为CH2CH2 | |
| C. | 分子式为C6H6的物质一定是苯 | |
| D. | 乙烯使溴水褪色说明乙烯与溴发生了取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的最高价氧化物的水化物能形成多种含Y元素的盐 | |
| B. | W的氧化物对应水化物的酸性一定强于Z | |
| C. | Y的单质应该保存在水中 | |
| D. | X的氢化物沸点比Z的氢化物沸点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com