
| A. | 用敞开放置久了的浓硫酸进行配制 | B. | 量取浓硫酸仰视刻度线 | ||
| C. | 配制过程中未洗涤烧杯和玻璃棒 | D. | 配制前,容量瓶有少许蒸馏水 |
分析 分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析,凡是使n偏大或者使V偏小的操作,溶液浓度偏高,反正溶液浓度偏低.
解答 解:A.敞开放置久了的浓硫酸,因为浓硫酸具有吸水性,所以溶液浓度降低,则量取的溶液含有溶质硫酸的物质的量偏小,溶液浓度偏低,故A不选;
B.量取浓硫酸仰视刻度线,导致量取的浓硫酸体积偏大,溶质硫酸的物质的量偏大,溶液浓度偏高,故B选;
C.配制过程中未洗涤烧杯和玻璃棒,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故C不选;
D.配制前,容量瓶有少许蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不受影响,故D不选;
故选:B.
点评 本题考查了一定物质的量浓度溶液配制误差分析,准确把握操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | SO2使品红、酸性高锰酸钾溶液褪色,分别体现了它的漂白性和还原性 | |
| B. | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变红,说明Fe(NO3)2样品已经变质 | |
| C. | 在未知溶液中滴加BaCl2溶液出现白色沉淀,加盐酸,沉淀不溶解,说明该溶液中一定存在SO42- | |
| D. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
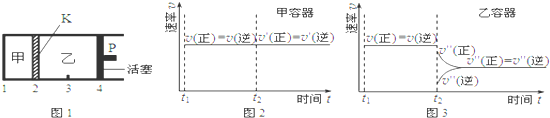
| A. | 保持活塞位置不变,降低温度,达到新的平衡后,甲、乙中B的体积分数均增大 | |
| B. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| C. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) | |
| D. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
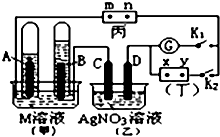 如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:
如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 由Ⅱ可知X中一定存在SiO2 | B. | 无法判断混合物中是否含有Na2O | ||
| C. | 1.92 g固体成分为Cu | D. | 15.6 g混合物X中m(Fe2O3):m(Cu)=1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
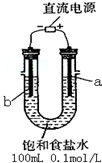
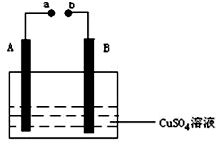 如图所示装置为在直流电的作用下电解CuSO4溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源后,通电一段时间后,将B电极取出洗干净并干燥后称量其质量增加了3.2g,则:
如图所示装置为在直流电的作用下电解CuSO4溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源后,通电一段时间后,将B电极取出洗干净并干燥后称量其质量增加了3.2g,则:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
| 完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红棕色的NO2加压后颜色先变深后变浅 | |
| B. | 钢铁在潮湿的空气中容易生锈 | |
| C. | 温度过高对合成氨不利 | |
| D. | 常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) | |
| B. | 物质的量浓度相等的CH3COOH和CH3COO Na 溶液等体积混合:c(CH3COOH)+c(CH3COO-)=2 c(Na+) | |
| C. | 硫酸铜溶液与过量浓氨水反应的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2 NH4+ | |
| D. | 一定浓度的盐酸和氨水混合可能出现c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com