
| A. | CSO的电子式: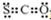 | B. | NaClO的电子式: | ||
| C. | CO2的分子示意图: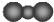 | D. | 次氯酸的结构式:H-Cl-O |
分析 A.CSO分子中含有1个C=S键和1个C=O键,各原子最外层都满足8电子稳定结构;
B.次氯酸钠为离子化合物,电子式中需要标出阴阳离子所带电荷;
C.二氧化碳分子中,碳原子的相对体积大于氧原子;
D.次氯酸的中心原子为氧原子,分子中不存在H-Cl键.
解答 解:A.CSO分子中各原子都达到8电子稳定结构,其电子式为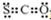 ,故A正确;
,故A正确;
B.NaClO是离子化合物,由Na+离子和ClO-离子构成,NaClO的电子式为 ,故B错误;
,故B错误;
C.二氧化碳为直线型结构,碳原子的相对体积大于氧原子,其正确的比例模型为 ,故C错误;
,故C错误;
D.次氯酸分子中含有1个H-O键和1个O-Cl键,其正确的结构式为H-O-Cl,故D错误;
故选A.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电子式、比例模型、结构式等知识,明确常见化学用语的书写原则为解答关键,试题有利于培养学生的规范答题能力.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:实验题
| 实验 序号 | 碳酸钙 状态 | c(HCl) /mol•L-1 | 溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 粒状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 粒状 | 0.6 | 20 | 41 | 280 |
| 4 | 粒状 | 0.8 | 20 | 40 | 200 |
| 5 | 粉末 | 0.8 | 20 | 40 | 30 |
| 6 | 粒状 | 1.0 | 20 | 40 | 120 |
| 7 | 粒状 | 1.0 | 30 | 50 | 40 |
| 8 | 粒状 | 1.2 | 20 | 40 | 90 |
| 9 | 粒状 | 1.2 | 25 | 45 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
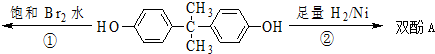
| A. | 双酚A的分子式是C15H16O2 | |
| B. | 双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3 | |
| C. | 反应①中,1 mol双酚A最多消耗4mol Br2 | |
| D. | 反应②的产物中有两种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
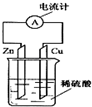 如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )| A. | 该装置将电能转变为化学能 | B. | 电流从锌片经导线流向铜片 | ||
| C. | 一段时间后,铜片质量减轻 | D. | 锌片上发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备溴苯时,将苯与溴水混合,剧烈振荡 | |
| B. | 除去甲烷中混有的二氧化碳时,依次通过烧碱溶液和浓硫酸 | |
| C. | 在酸性高锰酸钾溶液中滴加几滴苯,用力振荡,紫红色褪去 | |
| D. | 在苯中铜氢气制备环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44gN2O含有的氮原子数目为NA | |
| B. | 常温常压下,22.4 L N2含有的分子数目为NA | |
| C. | 1 mol Mg变为Mg2+时失去的电子数目为2NA | |
| D. | lmol•L-1K2CO3,溶液中含有的钾离子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com