
分析 MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,Mn元素的化合价降低,Cl的元素的化合价升高,以此来解答.
解答 解:在MnO2+4HCl (浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O的反应中,锰元素化合价降低,氯元素化合价升高,转移电子数为2mol,用“双线桥法”表示氧化还原反应中电子转移情况为: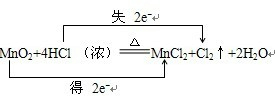 ;有0.5mol氯气生成,则转移的电子的数目是NA;被氧化的HCl为1mol,其质量为36.5g;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;反应中浓盐酸中部分HCl被氧化表现还原性,部分盐酸起酸性作用;
;有0.5mol氯气生成,则转移的电子的数目是NA;被氧化的HCl为1mol,其质量为36.5g;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;反应中浓盐酸中部分HCl被氧化表现还原性,部分盐酸起酸性作用;
故答案为: ;NA;36.5;MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;还原、酸.
;NA;36.5;MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;还原、酸.
点评 本题考查氧化还原反应,侧重基本概念及转移电子数的考查,明确反应中元素的化合价变化即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 原子由原子核和核外电子构成 | |
| B. | 对于任何微粒,质子数等于核外电子数都成立 | |
| C. | 当微粒达到稳定结构时,最外层电子数一定是8 | |
| D. | 原子的质量等于原子核的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量10.56gNa2CO3固体--用托盘天平 | |
| B. | 准确量取10.00mL的溶液--用50mL量筒 | |
| C. | 灼烧干海带至完全变成灰烬--用蒸发皿 | |
| D. | 过滤煮沸后的硬水--用普通漏斗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ④⑥ | C. | ②⑤⑥ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
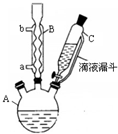 对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和浓药的合成,实验室中制备对氯苯甲酸的反应、装置图如图:
对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和浓药的合成,实验室中制备对氯苯甲酸的反应、装置图如图: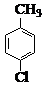 $→_{催化剂}^{KMnO_{4}}$
$→_{催化剂}^{KMnO_{4}}$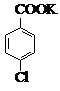 +MnO2
+MnO2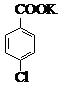
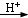
| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 颜色 | 水溶性 | |
| 对氯甲苯 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
| 对氯苯甲酸 | 243 | 275 | 1.54 | 白色 | 微溶 |
| 对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 物质 | 杂质 | 除杂试剂或操作方法 |
| ① | NaCl溶液 | Na2CO3 | 加入盐酸,蒸发 |
| ② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
| ③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
| ④ | NaNO3 | CaCO3 | 加稀盐酸溶解、过滤、蒸发、结晶 |
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
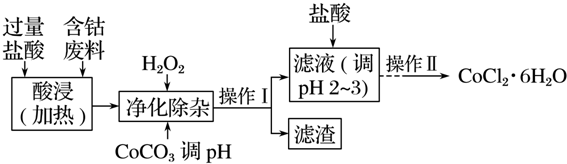
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com