
(18分)NOx、SO2是主要的大气污染物,科学处理这些污染物对改善人们的生存环境具有重要的现实意义。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ?mol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H= kJ?mol-1。
(2)利用氧化氮氧化物的流程如下:
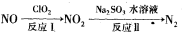
写出反应Ⅱ的化学方程式 ___________________;已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移0.5mol电子,则反应Ⅱ中可生成N2的体积
为_________L(标准状况下)。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡_________移动(填“向左”、“向右”或“不”);试计算溶液中  。
。
(常温下H2SO3的电离常数: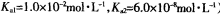 )
)
(4)利用Fe2(SO4)3溶液也可处理SO2废气,其流程如下图所示。
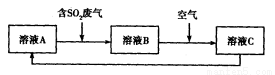
①简述用Fe2(SO4)3晶体配制溶液A的方法__________________。
②假设反应过程中溶液的体积不变,A、C两溶液的pH大小关系为:pH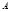 ___pH
___pH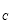 。(填
。(填
“>”、“=”或“<”)。
③设计实验验证溶液B是否仍具有处理废气的能力,简述实验的操作、现象和结论_____________________________________________________________________________。
(l)—11601。(2)2NO2+4Na2SO3 N2+4Na2SO4;1.12L。(3)向右;60。(4)①先将Fe2(SO4)3晶体溶于一定浓度的硫酸,再加水稀释到所需的浓度。②<。③取所得溶液少许,滴加硫氰酸钾溶液,若溶液变血红色,说明溶液B具有处理废气的能力,反之,不具有。
N2+4Na2SO4;1.12L。(3)向右;60。(4)①先将Fe2(SO4)3晶体溶于一定浓度的硫酸,再加水稀释到所需的浓度。②<。③取所得溶液少许,滴加硫氰酸钾溶液,若溶液变血红色,说明溶液B具有处理废气的能力,反之,不具有。
【解析】
试题分析:(l)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ?mol-1,根据盖斯定律:②×2—①,
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=—1160kJ?mol-1。(2)根据题给流程图知,反应Ⅱ为二氧化氮与亚硫酸钠溶液反应生成氮气和硫酸钠,化学方程式为2NO2+4Na2SO3 N2+4Na2SO4;由反应I知,生成1molNO2转移5mol电子,若反应I中转移0.5mol电子,则反应Ⅰ 中生成0.1molNO2,由反应Ⅱ可知,生成N2的物质的量为0.05mol,标准状况下体积为1.12L。(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中溶液由强碱溶液转化为水解呈碱性的盐溶液,水的电离平衡向右移动;由H2SO3的二级电离常数表达式表达式知,
N2+4Na2SO4;由反应I知,生成1molNO2转移5mol电子,若反应I中转移0.5mol电子,则反应Ⅰ 中生成0.1molNO2,由反应Ⅱ可知,生成N2的物质的量为0.05mol,标准状况下体积为1.12L。(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中溶液由强碱溶液转化为水解呈碱性的盐溶液,水的电离平衡向右移动;由H2SO3的二级电离常数表达式表达式知,  =Ka2/c(H+)=6.0×10—8/10—9=60。(4)①用Fe2(SO4)3晶体配制Fe2(SO4)3溶液时要注意防止铁离子水解,方法是先将Fe2(SO4)3晶体溶于一定浓度的硫酸,再加水稀释到所需的浓度。②由题给流程知,该过程中发生的总反应为:2SO2+O2+2H2O==2H2SO4,A、C两溶液的pH大小关系为:pHA<pHC。③验证溶液B是否仍具有处理废气的能力,即为检验溶液B中是否含有铁离子,实验的操作、现象和结论是取所得溶液少许,滴加硫氰酸钾溶液,若溶液变血红色,说明溶液B具有处理废气的能力,反之,不具有。
=Ka2/c(H+)=6.0×10—8/10—9=60。(4)①用Fe2(SO4)3晶体配制Fe2(SO4)3溶液时要注意防止铁离子水解,方法是先将Fe2(SO4)3晶体溶于一定浓度的硫酸,再加水稀释到所需的浓度。②由题给流程知,该过程中发生的总反应为:2SO2+O2+2H2O==2H2SO4,A、C两溶液的pH大小关系为:pHA<pHC。③验证溶液B是否仍具有处理废气的能力,即为检验溶液B中是否含有铁离子,实验的操作、现象和结论是取所得溶液少许,滴加硫氰酸钾溶液,若溶液变血红色,说明溶液B具有处理废气的能力,反之,不具有。
考点:考查焓变的计算、盖斯定律,氧化还原方程式的书写、电子守恒法和关系式法计算,水的电离、电离常数的计算及溶液的配制、离子检验。


科目:高中化学 来源:2013-2014山东省兰陵县下学期期中考试高二化学试卷(解析版) 题型:选择题
有8种物质:①甲烷;②苯;③聚乙烯;④1,3-丁二烯;⑤2-丁炔;⑥环己烷;⑦邻二甲苯;⑧环己烯。既能使酸性高锰酸钾溶液褪色又能与溴水因发生化学反应使之褪色的是 ( )
A.③④⑤⑧ B.④⑤⑦⑧ C.④⑤⑧ D.③④⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省乳山市下学期期中考试高一化学试卷(解析版) 题型:选择题
从下列实验事实所引起的相应结论不正确的是:
选项 | 实 验 事 实 | 结 论 |
A | 其它条件不变, 0.01mol/L的KMnO4酸性溶液分别与0.1mol/L的H2C2O4溶液和0.2mol/L的H2C2O4溶液反应,后者褪色时间短。 | 当其它条件不变时,增大反应物浓度可以使化学反应速率加快 |
B | 其它条件不变 | 当其它条件不变时,反应体系的温度越高、化学反应速率越快 |
C | 将少量MnO2粉末加入盛有10%双氧水的锥形瓶内,在化学反应前后,MnO2的质量和化学性质都没有发生改变。 | 催化剂虽然可以加快化学反应的速率,但一定不参与化学反应过程 |
D | 一定条件下,分别在容积为1L和容积为2L的两个密闭容器中加入等量的氢气和碘蒸气,发生如下反应:H2(g)+I2(g) | 当其它条件不变时,气态反应体系的压强越大、化学反应速率越快 |
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省临沂市高三三模试卷理科综合化学试卷(解析版) 题型:填空题
(18分)MnO2和Zn是制造干电池的重要原料,工业上用软锰矿(主要成分MnO2)和闪锌矿(主要成分ZnS)联合生产MnO2和Zn的工艺流程如下图所示:

(1)操作I用到硅酸盐材质的仪器有烧杯、玻璃棒和_______ _____(填仪器名称)。
(2)稀硫酸浸泡时反应的离子方程式为_______________________________________;该反应中若析出19.2g单质A,共转移____________mo1电子。浸泡时反应速率较慢,下列措施不能提高浸泡时反应速率的是________(填代号)。
a.将矿石粉碎
b.提高浸泡温度
c.适当增大硫酸浓度
d.改变软锰矿与闪锌矿的比例
(3)由硫酸锰溶液可得到固体碳酸锰,然后在空气中煅烧碳酸锰制备MnO2。已知:
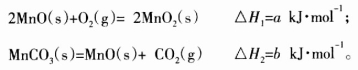
写出碳酸锰在空气中煅烧生成MnO2的热化学方程式_________________________。
(4)用惰性电极电解硫酸酸化的硫酸锰溶液制备MnO2的装置如下图所示:
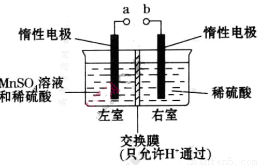
①a应与直流电源的_________(填“正”或“负”)极相连。.
②电解过程中氢离子的作用是______________和_____________;若转移的电子数为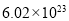 个,左室溶液中
个,左室溶液中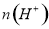 的变化量为________________。
的变化量为________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省临沂市高三三模试卷理科综合化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z的原子序数依次增大,Y为IA族元素,X与Z同主族,三种元素原子的最外层电子数之和为13。下列判断正确的是
A.元素X位于第2周期第ⅣA族
B.元素X分别与Y、Z形成的化合物都不止一种
C.单核离子半径大小顺序:X>Y>Z
D.Z的最简单氢化物的稳定性比X的强
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省临沂市高三5月二模理综化学试卷(解析版) 题型:选择题
某有机物的结构简式如图所示,下列有关该有机物的说法正确的是
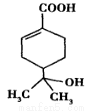
A.分子中含有两种官能团
B.可使溴水和酸性高锰酸钾溶液褪色,且原理相同
C.能发生加成、取代、氧化等反应
D.与钠和氢氧化钠溶液都能发生反应,且得到的产物相同
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省下学期高二期末化学模拟试卷(解析版) 题型:填空题
(10分)质谱、红外光谱、核磁共振等物理方法已成为研究有机物的重要组成部分。

(1) 下列物质中,其核磁共振氢谱中给出的峰值只有一个的是
A.CH3CH3 B.CH3COOH C.CH3COOCH3 D.CH3OCH3
(2)化合物A和B的分子式都是C2H4Br2, A的核磁共振氢谱图如右图所示,则A的结构简式为 ,请预测B的核磁共振氢谱上应该有 个峰(信号)。
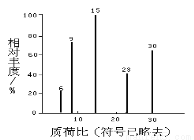
(3)化合物C中各原子数目比为:N(C):N(H):N(O)=1:2:1,对化合物C进行质谱分析可得到右图所示的质谱图,可得出其分子式为 。若对其进行红外光谱分析,可得出其官能团为 (写名称)。确定化合物C的官能团时,你认为 (填“有”或“没有”)必要进行红外光谱分析。写出化合物C与足量新制氢氧化铜反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省下学期高二期末化学模拟试卷(解析版) 题型:选择题
下列有关同系物的说法不正确的是
A.分子组成相差一个或若干个CH2原子团的化合物必定互为同系物
B.具有相同通式的有机物不一定互为同系物
C.两个相邻同系物的相对分子质量数值一定相差14
D.分子式为C3H8与C6H14的两种有机物一定互为同系物
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省皖南八校高三第三次联考理综化学试卷(解析版) 题型:选择题
下表中的实验操作能达到实验目的或能得出相应结论的是( )
选项 | 实验操作 | 实验目的或结论 |
A | 将混有Ca(OH)2杂质的Mg(OH)2样品,放入水中搅拌成浆状后,加入足量饱和氯化镁溶液充分搅拌、过滤,沉淀用蒸馏水洗涤。 | 除去Mg(OH)2样品中的Ca(OH)2 |
B | 取少量KClO3晶体溶于适量的蒸馏水,再加入硝酸 酸化的AgNO3溶液。 | 检验KC1O3中的氯元素 |
C | 向某溶液中滴加Ba(NO3)2溶液产生白色沉淀,再加稀盐酸沉淀消失。 | 说明原溶液中一定含有CO32-或SO32- |
D | 向盛有1mL 0.01lmol·L-1AgNO3溶液的试管中滴加5滴0.0lmol·L-1NaCl溶液,有白色沉淀生成,再向其中滴加0.01 mol·L-1 NaI溶液,产生黄色沉淀。 | 常温下, Ksp(AgCl)>Ksp(AgI)
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com