
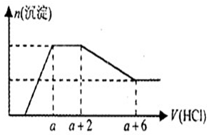
 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )| A. | 原溶液中一定含有Na2SO4 | |
| B. | 反应后形成的溶液溶质为NaCl | |
| C. | 原溶液中含有CO32-与AlO2-的物质的量比为1:1 | |
| D. | 原溶液中一定含有的离子是OH-,CO32-,SiO32-,AlO2- |
分析 由图可知,开始无沉淀生成说明加入的盐酸和溶液中的OH-反应,则与氢氧根离子反应的离子不能共存:Fe3+、Mg2+、Al3+;然后反应生成沉淀逐渐增大,说明是AlO2-和氢离子反应生成氢氧化铝沉淀和硅酸沉淀,继续加入盐酸沉淀量不变,消耗盐酸的离子只能是CO32-离子,反应完后继续加入盐酸,沉淀逐渐减小,到不再改变,进一步证明沉淀是氢氧化铝和硅酸沉淀,氢氧化铝沉淀溶于盐酸,最后剩余沉淀为硅酸;硫酸根离子不能确定存在,但根据溶液的电中性可知,溶液中至少含有K+、Na+离子中的一种,以此来解答.
解答 解:由图象可知,开始加入HCl时无沉淀生成,说明加入的HCl与溶液中OH-的反应,则溶液中一定不会存在与氢氧根离子发生反应的离子:Fe3+、Mg2+、Al3+;之后开始生成沉淀且反应生成沉淀逐渐增大,说明溶液中存在AlO2-、SiO32-,继续加入盐酸沉淀量不变,消耗盐酸的离子只能是CO32-离子,碳酸根离子反应完后继续加入盐酸,沉淀逐渐减小,到不再改变,进一步证明沉淀是氢氧化铝和硅酸沉淀,氢氧化铝沉淀溶于盐酸,最后剩余沉淀为硅酸;硫酸根离子不能确定存在,但根据溶液的电中性可知,溶液中至少含有K+、Na+离子中的一种离子,
A.根据分析可知,无法判断溶液中是否存在硫酸根离子,故A错误;
B.反应后形成的溶液溶质为NaCl或KCl,故B错误;
C.发生CO32-+2H+=CO2↑+H2O、Al(OH)3+3H+=Al3++3H2O,结合图可知和碳酸根离子反应的盐酸为2体积,氢氧化铝溶解消耗的盐酸体积为4体积,原溶液中含有CO32-与AlO2-的物质的量之比为3:4,故C错误;
D.根据以上分析可知,原溶液中一定存在的阴离子是:OH-、SiO32-、AlO2-、CO32-,故D正确;
故选D.
点评 本题考查常见离子的检验,为高频考点,把握离子的性质、离子之间的反应为解答的关键,侧重分析与推断能力的考查,注意图中消耗酸的体积及反应的先后顺序,题目难度中等.


科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该同学的实验目的是分离氯化钠、氯化钙 | |
| B. | 上图括号内的操作步骤均为加热蒸发 | |
| C. | 按此实验方案可得到较纯净的NaCl固体 | |
| D. | 按此实验方案可得到较纯净的CaCl2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(SO2)=4mol•L-1•min-1 | B. | v(O2)=3mol•L-1•min-1 | ||
| C. | v(SO2)=0.1mol•L-1•s-1 | D. | v(O2)=0.1mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 比较项 | 依据的化学反应事实 | |
| A | 比较Cl和S的非金属性 | Na2S+2HCl=2NaCl+H2S↑ |
| B | 比较Fe2+和Br-的还原性 | 2FeBr2+3Cl2(过量)=2FeCl3+2Br2 |
| C | 比较氯化银和碘化银溶解度 | AgCl(s)+I-少量(aq)=AgI(s)+Cl-(aq) |
| D | 比较硝酸和硫酸的酸性 | 3Cu+8HNO3(稀)═3Cu(NO3)2+4H2O+2NO↑ Cu和H2SO4(稀)不反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol/L | B. | 0.5 mol/L | C. | 2 mol/L | D. | 5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石燃料的直接利用,促进了低碳经济的发展 | |
| B. | 新材料的研制和应用,提高了人们的生活品质 | |
| C. | 合成药物的研发和使用,促进了医疗卫生事业的发展 | |
| D. | 化肥的合理使用提高了农作物产量,缓解了人类粮食危机 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com