
| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |
分析 C4H8ClBr可以可知丁烷中的2个H原子分别为1个Cl、1个Br原子取代,丁烷只有2种结构,氯原子与溴原子可以取代同一碳原子上的H原子,可以取代不同碳原子上的H原子,据此书写判断.
解答 解:先分析碳骨架异构,分别为 C-C-C-C 与 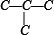 2种情况,然后分别对2种碳骨架采用“定一移一”的方法分析,
2种情况,然后分别对2种碳骨架采用“定一移一”的方法分析,
①骨架C-C-C-C上分别添加Cl、Br原子的种类有: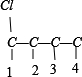 、
、 共8种,
共8种,
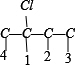
②骨架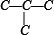 上分别添加Cl、Br原子的种类有有:
上分别添加Cl、Br原子的种类有有: 、
、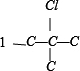 ,共 4 种,
,共 4 种,
所以满足分子式为C4H8ClBr的有机物共有12种,
故选B.
点评 本题考查同分异构体的书写,题目难度中等,明确同分异构体的书写原则为解答关键,注意掌握“定一移一”法在确定有机物同分异构体中的应用方法,试题培养了学生的灵活应用能力.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物 | |
| B. | 玛瑙和红宝石的主要成分都是SiO2,是制备半导体的材料 | |
| C. | 高温下SiO2能与Na2CO3反应放出CO2,说明硅酸酸性强于碳酸 | |
| D. | Na2SiO3溶液中逐滴加入盐酸可制备硅酸胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理(如图)与原电池的工作原理类似.
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理(如图)与原电池的工作原理类似.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
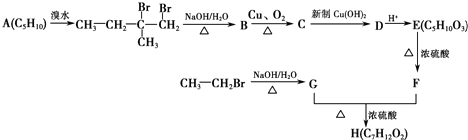
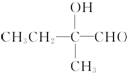 +2Cu(OH)2+OH-$\frac{\underline{\;\;△\;\;}}{\;}$
+2Cu(OH)2+OH-$\frac{\underline{\;\;△\;\;}}{\;}$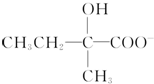 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.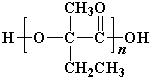 .
.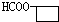 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体所绘制的图.请你根据图形判断,下列有关说法错误的是( )
如图是用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体所绘制的图.请你根据图形判断,下列有关说法错误的是( )| A. | CD段二氧化碳气体的体积小于BC段二氧化碳气体的体积 | |
| B. | 在OB、BC、CD三段中,BC段的反应速率最快,原因是该反应放热,温度在BC段起主要作用 | |
| C. | 相同条件下,向上述反应的溶液中加入NaCl溶液可降低化学反应的速率 | |
| D. | OB段反应物浓度大,所以OB段反应速率最快 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 该物质的化学式是C23H24O6 | |
| B. | 1mol该化合物最多可以与9molH2加成 | |
| C. | 酸性KMnO4溶液、溴水能与该物质发生氧化还原反应而褪色 | |
| D. | 该物质与FeCl3溶液作用可显红色,该反应可用于检验其中的酚羟基 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com