
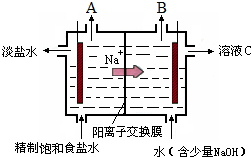
 氯碱工业中电解饱和食盐水的原理示意图如图所示:
氯碱工业中电解饱和食盐水的原理示意图如图所示:分析 (1)根据钠离子移动方向知,右侧为阴极、左侧为阳极,阳极上生成氯气,阴极上生成氢气同时有NaOH生成;氯气能使湿润的淀粉KI试纸变蓝色;
(2)阴极上水失电子生成氢气同时有OH-生成,导致阴极附近溶液呈碱性,酚酞遇碱变红色,;
(3)C溶液是NaOH溶液;
(4)电解饱和食盐水时,阴极上生成氢气同时生成NaOH、阳极上生成氯气;
(5)氯气与水反应生成HCl和HClO,酸能抑制氯气溶解;
(6)根据氢气和NaOH之间的关系式计算c(NaOH),再计算溶液的pH.
解答 解:(1)根据钠离子移动方向知,右侧为阴极、左侧为阳极,阳极上生成氯气,阴极上生成氢气同时有NaOH生成,所以A是氯气、B是氢气;氯气能使湿润的淀粉KI试纸变蓝色,可以用湿润的淀粉碘化钾试纸检验,其检验方法为,故答案为:氯气;用淀粉KI试纸至于A口附近,如果试纸变蓝,则说明A口生成了Cl2;
(2)阴极上水失电子生成氢气同时有OH-生成,导致阴极附近溶液呈碱性,酚酞遇碱变红色,则阴极溶液变红色,故答案为:阴;
(3)根据(1)知,B电极上生成氢气,则C溶液是NaOH溶液,故答案为:NaOH;
(4)电解饱和食盐水时,阴极上生成氢气同时生成NaOH、阳极上生成氯气,离子方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;
(5)氯气与水反应:Cl2+H2O?HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,利于氯气的逸出,
故答案为:氯气与水反应:Cl2+H2O?HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,利于氯气的逸出;
(6)n(H2)=$\frac{0.112L}{22.4L/mol}$=0.005mol,根据2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑得n(NaOH)=2n(H2)=2×0.005mol=0.01mol,c(NaOH)=$\frac{0.01mol}{0.1L}$=0.1mol/L,溶液的pH=13,
故答案为:13.
点评 本题考查电解原理,为高频考点,侧重考查学生分析计算能力,涉及电极反应式的书写、pH的计算、气体检验、平衡移动原理等知识点,明确基本原理及基本计算方法是解本题关键,知道氯气的检验方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
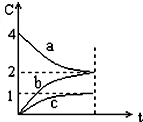
| A. | a是反应物 | B. | 正反应是一个体积扩大的反应 | ||
| C. | 正反应是放热反应 | D. | 若增大压强,平衡逆向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氯化铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3 | |
| B. | 在澄清石灰水中通入过量CO2:OH-+CO2=HCO3- | |
| C. | 在碳酸氢钙溶液中加入过量NaOH溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| D. | 碳酸钡中加入稀硫酸:BaCO3+2H+=Ba2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 标号 | HX | YOH | 溶液的体积关系 |
| ① | 强酸 | 强碱 | V(HX)=V(YOH) |
| ② | 强酸 | 强碱 | V(HX)<V(YOH) |
| ③ | 弱酸 | 弱碱 | V(HX)=V(YOH) |
| ④ | 弱酸 | 强碱 | V(HX)=V(YOH) |
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过渡元素全部都是副族元素 | |
| B. | 短周期共有32 种元素 | |
| C. | 科学研究时,经常在过渡元素中寻找耐高温、耐腐蚀的合金材料 | |
| D. | 元素周期表共七个横行代表七个周期,18 个纵横代表18 个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
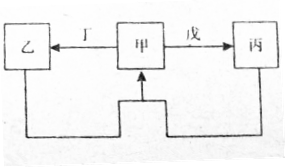
| A. | 假设:甲为Al(OH)3;结论:丁可能是盐酸 | |
| B. | 假设:甲为Na2CO3溶液;结论:戊可能是CO2 | |
| C. | 假设:甲为Fe;结论:丁可能是盐酸 | |
| D. | 假设:甲为N2;结论:戊可能是氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
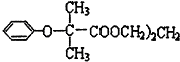 )可用于降低血液中的胆固醇,该物质合成线路如图所示:
)可用于降低血液中的胆固醇,该物质合成线路如图所示: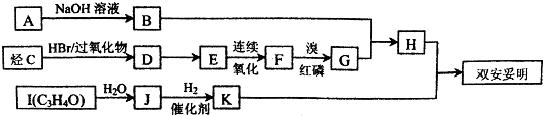
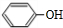
 $\stackrel{苯酚钠}{→}$
$\stackrel{苯酚钠}{→}$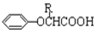
 ,J中所含官能团名称为醛基、羟基.
,J中所含官能团名称为醛基、羟基.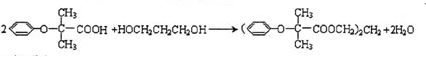 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com