
| m |
| M |
| n |
| V |
| m |
| M |
| 14.2g |
| 142g/mol |
| n |
| V |
| 0.1mol |
| 0.5L |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
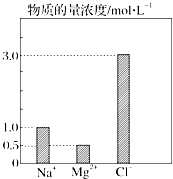 在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示.
在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、磷酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等 |
| B、6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14:1 |
| C、32g氧气所含的原子数目为2×6.02×1023 |
| D、CO的摩尔质量与NA个CO分子质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n×a% | ||
| B、n-m | ||
C、
| ||
| D、(n-m)×a% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下3.2 g O2中含有的氧原子数目为0.2 NA |
| B、101 kPa 0℃时,22.4 L氢气中含有NA个氢原子 |
| C、标准状况下,2.24 L 四氯化碳含有的碳原子数目为0.1NA |
| D、标准状况下,22.4LCl2和HCl的混合气体所含分子总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28g N2和28g CO所含的分子数都是NA |
| B、32g O3和32g O2所含的分子数都是NA |
| C、28g CO和44g CO2所含的氧原子数都是2NA |
| D、98g H2SO4和98g H3PO4所含的氧原子数都是4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 金属(M)的腐蚀是因为发生反应:M-ne-→Mn+.金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁的腐蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.
金属(M)的腐蚀是因为发生反应:M-ne-→Mn+.金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁的腐蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com