
����Ŀ�����Ѿ����ֵ�һ�ٶ���Ԫ���У���ϡ�������⣬�ǽ���Ԫ��ֻ��ʮ���֣������������������е���ϵ��
��1�����Ƕ�ֲ����������ȱ�ٵ�Ԫ�أ��ϳɰ��ķ�Ӧ����������ʳ�����Ӧ���£�
N2(g)��3H2(g) ![]() 2NH3(g)��
2NH3(g)��
�ٺϳɰ��ķ�Ӧ�е������仯��ͼ��ʾ��
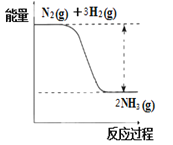
�÷�Ӧ��___________��Ӧ����������������������������ԭ���Ƿ�Ӧ�ﻯѧ���������յ�������_____����������������С�����������ﻯѧ���γɷų�����������
����һ�������£���һ������N2��H2�Ļ���������ij�����ܱ������У�һ��ʱ���������������˵���÷�Ӧ�ﵽƽ��״̬����___________������ţ���
A�������л��������ܶȲ���ʱ��仯
B����λʱ���ڶ���3 mol H-H����ͬʱ����6 mol N-H��
C�� N2 ��H2 ��NH3�����ʵ���֮��Ϊ1:3:2
D�������л�������ƽ����Է�����������ʱ��仯
��2�������ݻ�Ϊ1L��T2������ʼ��ϵ�м���1 mol N2 ��3molH2������5 min��Ӧ�ﵽƽ��ʱ��55.44kJ����������������¶Ȳ��䣬����ʼʱ�������ڷ���2 mol N2��6 mol H2����ƽ���ų�������ΪQ����Q___110.88 kJ(����>������<������=��)��
��3��Ŀǰ��ҵ����һ�ַ�������CO2����ȼ�ϼ״���һ�������·�����Ӧ��CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)�������Ϊ1 L���ܱ������У�����1 molCO2��3 molH2�����CO2��CH3OH(g)��Ũ����ʱ��仯����ͼ��ʾ��
CH3OH(g)+H2O(g)�������Ϊ1 L���ܱ������У�����1 molCO2��3 molH2�����CO2��CH3OH(g)��Ũ����ʱ��仯����ͼ��ʾ��
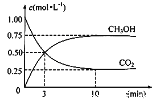
��ƽ��ʱ������ƽ��ʱ����ʼʱ��ѹǿ֮��___��
��4���п��淴ӦFe(s)+CO2(g) ![]() FeO(s) + CO(g) ��H>0��
FeO(s) + CO(g) ��H>0��
������ʼʱ��Fe��CO2��������̶����ܱ������У�CO2����ʼŨ��Ϊ2.0mol/L��ij�¶�ʱ�ﵽƽ�⣬��ʱ������CO��Ũ��Ϊ1.0 mol/L������¶���������Ӧ��ƽ�ⳣ��K=______________��������λ��Ч���֣���
�����÷�Ӧ������̶����ܱ������н��У���һ�������´ﵽƽ��״̬������ı�������������Ӧ���������CO2�����ʵ���������α仯��ѡ����������������С���������������������¶�________________����ͨ��CO_________________��
�۸÷�Ӧ���淴Ӧ������ʱ��仯�Ĺ�ϵ��ͼ��
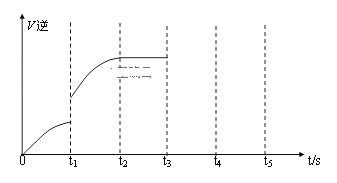
��ͼ�п�������Ӧ��t2ʱ��ƽ�⣬ ��t1ʱ�ı���ij���������ı�����������ǣ�����ţ�______________������ѡ��
A������ B������CO2Ũ��
�������t3ʱ�ӻ�����з��������CO��t4~ t5ʱ��η�Ӧ������ƽ��״̬������ͼ�ϻ���t3~ t5��V���棩�仯����____________________________��
���𰸡����� С�� AC > 5:8 1.0 ��С ���� A 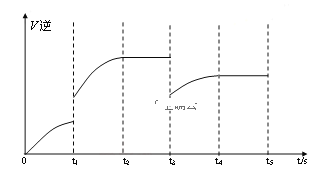
��������
��1������ͼ��֪����Ӧ�������������������������������ѻ�ѧ���������������ɻ�ѧ���ͷ�������
�ڽ��ƽ��ʱ���淴Ӧ������ȡ�����ֵ�Ũ�Ȳ���ȼ���������һЩ������������
��2������ʼʱ�������ڷ���2mol N2��6mol H2���൱������ѹǿƽ��������С�
��3����Ӧǰ������ѹǿ֮�ȵ��������ʵ���֮�ȣ�
��4���ٸ��ݶ�����̼��һ����̼��Ũ�ȼ����ƽ�ⳣ����
�ڸ���Ӱ�컯ѧƽ�ⳣ�������ؽ��з�����
�۸�����ͼt1ʱ�̣���Ӧ����ͻȻ�����Լ��淴Ӧ���ʺ�����������䣻
�ܸ��ݷ��������CO���淴Ӧ���ʼ�С������Ӧ����˲�䲻�仭��t3��t5��v���棩�仯���ߡ�
��1������ͼ��֪����Ӧ������������������������������÷�ӦΪ���ȷ�Ӧ�����ѻ�ѧ���������������ɻ�ѧ���ͷ���������H=���ѻ�ѧ����������-���ɻ�ѧ���ͷ�������0����֪���ѻ�ѧ����������С�����ɻ�ѧ���ͷ�������
�ʴ�Ϊ�����ȣ�С�ڣ�
��A����������������Լ�������������䣬�������л��������ܶȲ���ʱ��仯�����������ж��Ƿ�ﵽƽ�⣬��A����
B����λʱ���ڶ���3mol H-H����ͬʱ����6mol N-H����˵�����淴Ӧ������ȣ��ﵽƽ��״̬����B��ȷ��
C�� ����ȷ����ʼ�������ת�����Լ�ƽ�ⳣ������N2��H2��NH3�����ʵ���֮��Ϊ1��3��2����˵���ﵽƽ��״̬����C����
D�������л�������ƽ����Է�����������ʱ��仯��˵����������ʵ������䣬�ﵽƽ��״̬����D��ȷ��
�ʴ�Ϊ��AC��
��2������ʼʱ�������ڷ���2mol N2��6mol H2��Ũ��Ϊԭ�������������ﵽ���ǵ�Чƽ�⣬��ų�������Ϊ110.88 kJ����ʵ�������൱������ѹǿƽ��������У��ų������������ʷų�����������110.88 kJ��
�ʴ�Ϊ������
��3����Ӧǰ������ѹǿ֮�ȵ��������ʵ���֮�ȣ���Ӧǰ�������ʵ���=4mol���״�����0.75mol�����ﵽƽ��״̬������̼���ʵ���0.25mol��������ʽ��
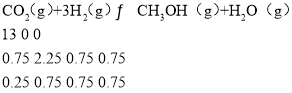
��ƽ��ʱ������ƽ��ʱ����ʼʱ��ѹǿ֮��=��0.25+0.75+0.75+0.75������1+3��=5��8��
�ʴ�Ϊ��5��8��
��4�����ɿ��淴ӦFe��s��+CO2��g��FeO��s��+CO��g�����÷�Ӧ��ƽ�ⳣ������ʽΪ��K=![]() ��CO2����ʼŨ��Ϊ2.0mol/L��ij�¶�ʱ�ﵽƽ�⣬��ʱ������CO��Ũ��Ϊ1.0mol/L����Ӧ���ĵĶ�����̼��Ũ��Ϊ��1.0mol/L���ﵽƽ��ʱ������̼Ũ��Ϊ1.0mol/L������¶��µ�ƽ�ⳣ��Ϊ��K=
��CO2����ʼŨ��Ϊ2.0mol/L��ij�¶�ʱ�ﵽƽ�⣬��ʱ������CO��Ũ��Ϊ1.0mol/L����Ӧ���ĵĶ�����̼��Ũ��Ϊ��1.0mol/L���ﵽƽ��ʱ������̼Ũ��Ϊ1.0mol/L������¶��µ�ƽ�ⳣ��Ϊ��K=![]() =1.0��
=1.0��
�ʴ�Ϊ��1.0��
�ڸ÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�����������ƶ���������̼�����������С����ͨ��CO������ѹǿ��Ӱ�컯ѧƽ�⣬�ﵽƽ��ʱ����ֵĺ������䣬
�ʴ�Ϊ����С�����䣻
��A�����£������淴Ӧ����ͻȻ�������ŷ�Ӧ�Ľ��У��������Ũ�������淴Ӧ����������䣬��A��ȷ��
B������CO2��Ũ�ȣ�����Ӧ����ͻȻ�����淴Ӧ����˲�䲻�䣬��B����
��ѡ��A��
�������t3ʱ�ӻ�����з��������CO���淴Ӧ���ʼ�С������Ӧ����˲�䲻�䣬ƽ�����������ƶ������ŷ�Ӧ�Ľ��У��������Ũ���������淴Ӧ������������䣬��ͼ��ʾ�� ��
��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������л���A![]() ��B(
��B(![]() ),�����й����ǵ�˵������ȷ����(����)
),�����й����ǵ�˵������ȷ����(����)
A.һ��������,������NaOH��Һ�о��ɷ���ȡ����Ӧ
B.������NaOH����Һ�о��ɷ�����ȥ��Ӧ
C.���ߵĺ˴Ź��������о�ֻ�������ַ��ҷ����֮��Ϊ3��2
D.A��һ�ȴ���ֻ��1�֡�B��һ�������2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ǹ�ҵ���Ʊ�Na2S2O3�ķ���֮һ����Ӧԭ����2Na2S��Na2CO3��4SO2=3Na2S2O3��CO2(�÷�Ӧ��H��0)��ij�о�С����ʵ��������Ʊ�Na2S2O3��5H2O�������£�
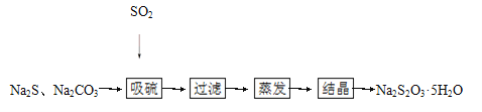
��1������װ����ͼ��ʾ��
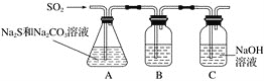
��װ��B�������Ǽ���װ��A��SO2������Ч�ʣ�B���Լ���____________������SO2����Ч�ʵ͵�ʵ��������B��_________��
��Ϊ��ʹSO2������������ȫ���ڲ��ı�A����ҺŨ�ȡ�����������£����˼�ʱ���跴Ӧ���⣬���ɲ�ȡ�ĺ�����ʩ��________��________��(д������)
��2��Na2S2O3��Һ�Ƕ���ʵ���еij����Լ����ⶨ��Ũ�ȵĹ������£�ȷ��ȡag KIO3(��ѧʽ����214)���������Һ���������KI�����H2SO4��Һ���μ�ָʾ������Na2S2O3��Һ�ζ����յ㣬����Na2S2O3��Һ�����ΪVmL����c(Na2S2O3)��_________ mol��L��1��(ֻ�г���ʽ����������)��֪��![]() ��I2=
��I2=![]() ��2I��
��2I��
��3��ijͬѧ��һ���͵ڶ����IJ������ܹ淶������������̫����������õ�Na2S2O3Ũ�ȿ��� ____(������Ӱ��������ƫ��������ƫ����)��ԭ����_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������巴Ӧ�ﵽ��ѧƽ�⣬ƽ�ⳣ��K��c(A)��c2(B)/[c2(E)��c(F)]������ʱ�����¶��ʵ����ͣ�F��Ũ�����ӣ�����˵����ȷ����( )
A. ����c(A)��c(B)��K����
B. �����¶ȣ�����Ӧ��������
C. �÷�Ӧ���ʱ�Ϊ��ֵ
D. �÷�Ӧ�Ļ�ѧ����ʽΪ2E(g)��F(g)![]() A(g)��2B(g)
A(g)��2B(g)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2CO(g)+O2(g)=2CO2(g) ��H= ��566 kJmol��1
Na2O2(s)+CO2(g) = Na2CO3(s)+1/2O2(g) ��H= ��226 kJmol��1
���б�����ȷ����
A.1molCOȼ��ʱ�ų�������Ϊ283kJmol��1
B.Na2O2(s)+CO(g)=Na2CO3(s)��H=��509kJmol-1
C.Na2O2(s)��CO2(g)��Ӧ�ų�226kJ����ʱ����ת����Ϊ2NA
D.Na2O2��Na2CO3���������Ӹ����Ȳ�ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��º�ѹ��,���ܱ������г���4 mol SO2��2 mol O2,�������·�Ӧ:2SO2��g��+O2��g��![]() 2SO3��g����H<0��2 min��,��Ӧ�ﵽƽ��,����SO3Ϊ1.4 mol,ͬʱ�ų�����QkJ�������з�����ȷ����
2SO3��g����H<0��2 min��,��Ӧ�ﵽƽ��,����SO3Ϊ1.4 mol,ͬʱ�ų�����QkJ�������з�����ȷ����
A. ����Ӧ��ʼʱ�������Ϊ2 L,��v(SO3)=0.35 mol��L-1��min-1
B. 2 min��,����������ͨ��һ������SO3���壬���´ﵽƽ��ʱ��SO2�ĺ�������
C. �������������º�ѹ����Ϊ����ѹ������,��ƽ���n(SO3)����1.4 mol
D. �������������º�ѹ����Ϊ�����º�����,��ƽ��ʱ�ų�����С��QkJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������еķ�ӦΪ2NO2(g)+O3(g)![]() N2O5(g)+O2(g)�����˷�Ӧ�ں����ܱ������н��У�����ѡ�����й�ͼ���Ӧ�ķ�����ȷ���ǣ� ��
N2O5(g)+O2(g)�����˷�Ӧ�ں����ܱ������н��У�����ѡ�����й�ͼ���Ӧ�ķ�����ȷ���ǣ� ��
A.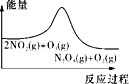 ƽ������£�NO2��������
ƽ������£�NO2��������
B.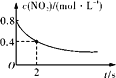 0��2 s�ڣ�v(O3)��0.2 mol��L��1��s��1
0��2 s�ڣ�v(O3)��0.2 mol��L��1��s��1
C.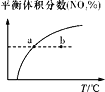 v����b��>a�㣬b�㣺v�� > v��
v����b��>a�㣬b�㣺v�� > v��
D.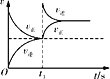 ���£�t1ʱ�ٳ���O3
���£�t1ʱ�ٳ���O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܱ�ʾH2(g)+ I2(g)![]() 2HI(g)�Ѿ��ﵽƽ��״̬�ı�־�ǣ� ��
2HI(g)�Ѿ��ﵽƽ��״̬�ı�־�ǣ� ��
��c(H2)=c(I2)=c(HI)ʱ
��c(H2)��c(I2)��c(HI)=1��1��2ʱ
��c(H2)��c(I2)��c(HI)������ʱ����ı�
�ܵ�λʱ��������nmolH2��ͬʱ����2nmolHI
�ݵ�λʱ��������nmolH2��ͬʱ����nmolI2
��Ӧ��v(H2)=v(I2)=1/2v(HI)
��һ��H-H�����ѵ�ͬʱ������H-I������
���¶Ⱥ����һ��ʱ��������ѹǿ���ٱ仯
���¶Ⱥ����һ��ʱ������������ɫ���ٱ仯
���¶Ⱥ�ѹǿһ��ʱ�����������ܶȲ��ٱ仯
����һ������������ƽ����Է����������ٱ仯
A.�ۢܢߢ��B.�ۢܢߢ�C.�ڢۢܢߢ�D.�ڢۢܢޢߢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ�����£���O2����a mol/L FeCl2��Һ�����������ʵ��������ͼ��ʾ�����з������Ʋ��������
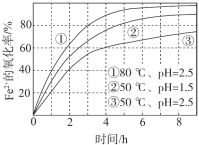
A. �ɢ١��ڿ�֪�� pHԽ��+2����Խ�ױ�����
B. �ɢڡ����Ʋ⣬��pH��7��+2�������ѱ�����
C. �ɢ١����Ʋ⣬FeCl2��O2�����ķ�ӦΪ���ȷ�Ӧ
D. 60�桢pH=2.5ʱ�� 4 h��Fe2+��ƽ���������ʴ��� 0.15a mol/(L��h)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com