
| A. | 食盐、淡水 | B. | 氯、溴、碘 | C. | 钠、镁 | D. | 烧碱、氢气 |
分析 根据海水中资源的获取方法,氯化钠含量比较高,可以通过晾晒的方法得到,而纯碱和其它元素的单质则需要化学反应才能得到.据此即可解答.
解答 解:A.氯化钠在海水中的浓度很大,用蒸馏等方法可以从海水中得到淡水,海水经太阳暴晒,蒸发水分后即得食盐,不需要化学变化就能够从海水中获得,故A正确;
B.从海水中提炼溴和碘,是用氯气把其中的碘离子和溴离子氧化为碘单质和溴单质,是化学变化,故B错误;
C.要从海水中得到钠、镁,需要首先从海水中获得氯化钠和氯化镁,然后再去电解熔融状态的氯化钠和氯化镁,得钠和镁,是化学变化,故C错误;
D.电解饱和食盐水,得到烧碱、氢气和氯气,是化学变化,故D错误;
故选A.
点评 本题考查了从海水中获取化合物和单质的方法,熟悉物质的存在及物质的性质是解答本题的关键,题目较简单.


科目:高中化学 来源: 题型:解答题
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
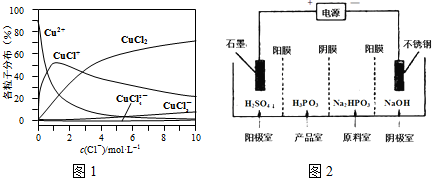
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室常用以下方法制取氯气:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答
实验室常用以下方法制取氯气:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种 | B. | 三种 | C. | 四种 | D. | 五种 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 ,
, ,反应E-→F的化学方程式是:
,反应E-→F的化学方程式是: $→_{△}^{氢氧化钠/醇溶液}$
$→_{△}^{氢氧化钠/醇溶液}$ +HBr.
+HBr.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com