

 .
.

 与1mol O2恰好可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式
与1mol O2恰好可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式 .
. ;扑热息痛的结构简式为
;扑热息痛的结构简式为 .
. .
. 分析 苯和丙烯发生加成反应生成异苯丙烷,异苯丙烷被氧化生成A和B,B和氢氰酸发生加成反应生成 ,则B是丙酮,1mol
,则B是丙酮,1mol  可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,说明A中含有酚羟基,根据碳原子守恒知A是苯酚,
可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,说明A中含有酚羟基,根据碳原子守恒知A是苯酚, 发生反应生成D,D蒸气密度是相同状态下甲烷密度的6.25倍,则D的相对分子质量是100,D中各元素的质量分数分别为碳60%,氢8%,氧32%,则碳、氢、氧原子个数比=$\frac{60%}{12}$:$\frac{8%}{1}$:$\frac{32%}{16}$=5:8:2,D的相对分子质量是100,则D的分子式为:C5H8O2,D的不饱和度=$\frac{2×5+2-8}{2}$,所以D中含有碳碳双键,且含有酯基,所以D的结构简式为:CH2=C(CH3)COOCH3,D发生加聚反应生成F;异丙烯酸和SOCl2发生取代反应生成G,G的结构简式为:CH2=C(CH3)COCl,G反应生成H,H反应生成
发生反应生成D,D蒸气密度是相同状态下甲烷密度的6.25倍,则D的相对分子质量是100,D中各元素的质量分数分别为碳60%,氢8%,氧32%,则碳、氢、氧原子个数比=$\frac{60%}{12}$:$\frac{8%}{1}$:$\frac{32%}{16}$=5:8:2,D的相对分子质量是100,则D的分子式为:C5H8O2,D的不饱和度=$\frac{2×5+2-8}{2}$,所以D中含有碳碳双键,且含有酯基,所以D的结构简式为:CH2=C(CH3)COOCH3,D发生加聚反应生成F;异丙烯酸和SOCl2发生取代反应生成G,G的结构简式为:CH2=C(CH3)COCl,G反应生成H,H反应生成 ,则H是
,则H是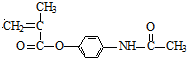 ,据此答题.
,据此答题.
解答 解:苯和丙烯发生加成反应生成异苯丙烷,异苯丙烷被氧化生成A和B,B和氢氰酸发生加成反应生成 ,则B是丙酮,1mol
,则B是丙酮,1mol  可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,说明A中含有酚羟基,根据碳原子守恒知A是苯酚,
可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,说明A中含有酚羟基,根据碳原子守恒知A是苯酚, 发生反应生成D,D蒸气密度是相同状态下甲烷密度的6.25倍,则D的相对分子质量是100,D中各元素的质量分数分别为碳60%,氢8%,氧32%,则碳、氢、氧原子个数比=$\frac{60%}{12}$:$\frac{8%}{1}$:$\frac{32%}{16}$=5:8:2,D的相对分子质量是100,则D的分子式为:C5H8O2,D的不饱和度=$\frac{2×5+2-8}{2}$,所以D中含有碳碳双键,且含有酯基,所以D的结构简式为:CH2=C(CH3)COOCH3,D发生加聚反应生成F;异丙烯酸和SOCl2发生取代反应生成G,G的结构简式为:CH2=C(CH3)COCl,G反应生成H,H反应生成
发生反应生成D,D蒸气密度是相同状态下甲烷密度的6.25倍,则D的相对分子质量是100,D中各元素的质量分数分别为碳60%,氢8%,氧32%,则碳、氢、氧原子个数比=$\frac{60%}{12}$:$\frac{8%}{1}$:$\frac{32%}{16}$=5:8:2,D的相对分子质量是100,则D的分子式为:C5H8O2,D的不饱和度=$\frac{2×5+2-8}{2}$,所以D中含有碳碳双键,且含有酯基,所以D的结构简式为:CH2=C(CH3)COOCH3,D发生加聚反应生成F;异丙烯酸和SOCl2发生取代反应生成G,G的结构简式为:CH2=C(CH3)COCl,G反应生成H,H反应生成 ,则H是
,则H是 ,
,
(1)苯和丙烯发生加成反应生成异苯丙烷,所以①的反应类型为加成反应,通过以上分析知G的分子式为 C4H5OCl,故答案为:加成反应,C4H5OCl;
(2)A是苯酚,苯酚和溴水发生取代反应,反应方程式为 ,
,
故答案为: ;
;
(3)通过以上分析知,B的结构简式为: ,扑热息痛的结构简式为
,扑热息痛的结构简式为 ,
,
故答案为: ;
; ;
;
(4)D的结构简式为:CH2=C(CH3)COOCH3,D分子中的含氧官能团为酯基,故答案为:酯基;
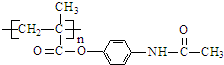
(5)扑热息痛高分子药物与足量氢氧化钠溶液发生反应的化学方程式为 ,
,
故答案为: .
.
点评 本题考查了有机物的合成,明确有机物的官能团及其性质是解本题关键,采用正逆相结合的方法进行分析,难点是同分异构体种类的判断,注意有碳链异构、官能团异构和顺反异构,难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{36.5a}{22.4(a+1)d}$ | B. | $\frac{1000ad}{36.5a+22.4}$ | ||
| C. | $\frac{ad}{36.5a+22400}$ | D. | $\frac{1000ad}{36.5a+22400}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中次磷酸根离子得电子,表现还原性 | |
| B. | 该反应中氧化剂与还原剂的物质的量之比为1:1 | |
| C. | 若将硫酸铜溶液换成硝酸银溶液,容器内壁不会形成镀层 | |
| D. | 该反应每消耗3 mol X-,转移电子的物质的量为2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+2 O2 $\stackrel{点燃}{→}$ CO2+2H2O | |
| B. | CH2=CH2+H2 $\stackrel{催化剂}{→}$ CH3-CH3 | |
| C. |  +Br2 $\stackrel{FeBr_{3}}{→}$ +Br2 $\stackrel{FeBr_{3}}{→}$ +HBr +HBr | |
| D. | 2CH3CH2OH+O2 $→_{△}^{Cu或Ag}$ 2CH3CHO+2 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铁片上发生氧化反应Fe-3e-═Fe3+ | B. | 铜片上发生还原反应2H++2e-═H2↑ | ||
| C. | 铜片上发生氧化反应Cu-2e-═Cu2+ | D. | 溶液中NO${\;}_{3}^{-}$的浓度基本不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨反应N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g)△H<0 具有重要的意义.
合成氨反应N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g)△H<0 具有重要的意义.| T/K | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙和稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 铁粉和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 向澄清石灰水中通入少量CO2:Ca2++2OH-+CO2═CaCO3↓+H2O | |
| D. | 硫酸铜溶液和氢氧化钡溶液混合:SO42-+Ba2+═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液和稀H2SO4的反应 | B. | Cu(OH)2和稀H2SO4的反应 | ||
| C. | NaOH溶液和氢溴酸反应 | D. | NaOH溶液和醋酸溶液的反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com