

���� ��1����������ǿ��̼�ᣬ���Բ����ܺ�̼�����Ʒ�Ӧ���ɶ�����̼��
��2�������Ը��������Һ����ǿ�����ԣ�������ʹ���Ը��������Һ��ɫ��˵�������ܽ����Ը��������Һ��ԭ�����������ԭ�������ɵ������������������ӿ췴Ӧ���ʣ�
�ڸ÷�Ӧ��MnԪ�ػ��ϼ���+7�۱�Ϊ+2�ۡ�CԪ�ػ��ϼ���+3�۱�Ϊ+4�ۣ�ת�Ƶ�������10������ת�Ƶ����غ㡢ԭ���غ㡢����غ���ƽ����ʽ��
��3������ȶ��������ֽ⣬�Ҳ��������������Էֽ�����к��в��ᣬ���᳣����Ϊ��ɫ���壬����Bװ����������ȴ����������Cװ���Ǽ��������̼��Dװ���м�����Һ�������ն�����̼��Eװ�ü��������̼�Ƿ������Fװ�ø������壬���Gװ���й�����ɫ��Hװ����Һ����ǣ�˵�����������к���CO��
��C��Hװ�þ�����ǣ�˵�����ж�����̼��E��������˵����D�������������в���������̼��G���������ɫ���ɫ��˵�����л�ԭ�����壬���ݷ�Ӧ��������P��Ӧ������д����ʽ��
��Bװ�þ�����ȴ���ã�Dװ�����ն�����̼��CO�ж�������ֱ���ſգ�
��4��n��H2C2O4•2H2O��=$\frac{2.52g}{126g/mol}$=0.02mol��n��NaOH��=0.2mol/L��0.1L=0.02mol������ǡ����ȫ��Ӧ���ɲ������ƣ���Ϻ���Һ�����ԣ�˵������������ӵ���̶ȴ���ˮ��̶ȣ���ϵ���غ��ж�����Ũ�ȴ�С��
��� �⣺��1����������ǿ��̼�ᣬ���Բ����ܺ�̼�����Ʒ�Ӧ���ɶ�����̼�����ӷ���ʽΪHCO3-+H2C2O4�THC2O4-+CO2��+H2O��
�ʴ�Ϊ��HCO3-+H2C2O4�THC2O4-+CO2��+H2O��
��2�������Ը��������Һ����ǿ�����ԣ�������ʹ���Ը��������Һ��ɫ��˵�������ܽ����Ը��������Һ��ԭ�����������ԭ������������ֻ�ԭ�ԣ����ɵ������������������ӿ췴Ӧ���ʣ�
�ʴ�Ϊ����ԭ����Ӧ������������������û�������Ũ�����ӣ��ӿ��˷�Ӧ���ʣ�
�ڸ÷�Ӧ��MnԪ�ػ��ϼ���+7�۱�Ϊ+2�ۡ�CԪ�ػ��ϼ���+3�۱�Ϊ+4�ۣ�ת�Ƶ�������10������ת�Ƶ����غ㡢ԭ���غ㡢����غ���ƽ����ʽΪ2MnO4-+5H2C2O4+6H+�T2Mn2++10CO2��+8H2O��
�ʴ�Ϊ��2��5��6��2��10��8H2O��
��3������ȶ��������ֽ⣬�Ҳ��������������Էֽ�����к��в��ᣬ���᳣����Ϊ��ɫ���壬����Bװ����������ȴ����������Cװ���Ǽ��������̼��Dװ���м�����Һ�������ն�����̼��Eװ�ü��������̼�Ƿ������Fװ�ø������壬���Gװ���й�����ɫ��Hװ����Һ����ǣ�˵�����������к���CO��
��C��Hװ�þ�����ǣ�˵�����ж�����̼��E��������˵����D�������������в���������̼��G���������ɫ���ɫ��˵�����л�ԭ�����壬���ݷ�Ӧ��������P��Ӧ������д����ʽΪH2C2O4$\frac{\underline{\;\;��\;\;}}{\;}$H2O+CO��+CO2�����ʴ�Ϊ��H2C2O4$\frac{\underline{\;\;��\;\;}}{\;}$H2O+CO��+CO2����
�ڲ����ܺ��������Ʒ�Ӧ���ɳ��������Ŷ�����̼���飬����Bװ�þ�����ȴ�����������ã�����Զ�����̼����ĸ��ţ�Dװ�����ն�����̼����ȥ��������еĶ�����̼��CO�ж�������ֱ���ſգ�����Ӧ����β������װ�ã�
�ʴ�Ϊ��������������������Զ�����̼�ļ���������ţ���ȥ��������е�CO2��û��β������װ�ã�
��4��n��H2C2O4•2H2O��=$\frac{2.52g}{126g/mol}$=0.02mol��n��NaOH��=0.2mol/L��0.1L=0.02mol������ǡ����ȫ��Ӧ���ɲ������ƣ���Ϻ���Һ�����ԣ�˵������������ӵ���̶ȴ���ˮ��̶ȣ�ˮ�������������ӣ���ϵ���غ��ж�����Ũ�ȴ�СΪNa+��HC2O4-��H+��C2O4-��OH-���ʴ�Ϊ��Na+��HC2O4-��H+��C2O4-��OH-��
���� ���⿼������ʵ�鷽����ƣ�Ϊ��Ƶ���㣬��ȷʵ��ԭ�����������ʡ����鷽���ǽⱾ��ؼ���֪������װ�õ����ü�ʵ������ע�������̼��CO�����Ⱥ�˳����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ${\;}_{\;}^{16}$O2��${\;}_{\;}^{18}$O2����Ԫ�ص����ֺ��� | |
| B�� | ��״���£�1.12L${\;}_{\;}^{16}$O2��1.12L${\;}_{\;}^{18}$O2������0.1NA����ԭ�� | |
| C�� | ͨ����ѧ�仯����ʵ��${\;}_{\;}^{16}$O��${\;}_{\;}^{18}$O֮����ת�� | |
| D�� | ${\;}_{\;}^{16}$O��${\;}_{\;}^{18}$O��������Ų���ʽ��ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
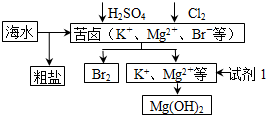
| A�� | ��ҵ�ϣ��������MgOұ������þ�ɼ�С�ܺ� | |
| B�� | �ӿ�±����ȡBr2�ķ�Ӧ�����ӷ���ʽΪ2Br -+Cl2�T2Cl-+Br2 | |
| C�� | �Լ�1����ѡ��ʯ���� | |
| D�� | ����BaCl2��Һ��ȥ�����е�SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
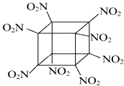 ��ѧ�����Ƴ��İ����������飨�ṹ��ͼ��ʾ��̼ԭ��δ��������һ��������ըҩ����ը�ֽ�õ������ȶ������壬����˵����ȷ���ǣ�������
��ѧ�����Ƴ��İ����������飨�ṹ��ͼ��ʾ��̼ԭ��δ��������һ��������ըҩ����ը�ֽ�õ������ȶ������壬����˵����ȷ���ǣ�������| A�� | �����ʱ�ը������N2��CO2��H2O | |
| B�� | 1 mol�÷����к�8 mol�������� | |
| C�� | �����ʿ��������鷢��ȡ����Ӧ�Ƶ� | |
| D�� | C��N���γɷǼ��Լ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.3mol | B�� | 0.4mol | C�� | 0.5mol | D�� | 0.6mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Na2CO3������Һ�У�ͨ�������CO2�������ɵ�NaHCO3���� | |
| B�� | ��������CuCl2������Һ�ô�����CuCl2���� | |
| C�� | ��FeBr2��Һ�м����������ˮ������������FeCl3���� | |
| D�� | ��FeCl3��Һ���������NaOH��Һ�������ˡ�ϴ�ӳ������ٳ�����ճ�����Fe2O3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com