
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.c(ClO-)=1.0mol·L-1的溶液中:Na+、SO32-、S2-、SO42-
B.由水电离的c(H+)=1×10-12 mol·L-1的溶液中:Ba2+、K+、Cl-、NO3-
C.常温下,c(H+)/c(OH-)=10-10的溶液中:Ca2+、Mg2+、HCO3-、I-
D.滴入少量KSCN溶液显红色的溶液中:Na+、K+、I-、SO42-
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源:2014-2015学年山东省高三上学期期中考试化学试卷(解析版) 题型:选择题
Al、Fe、Cu都是重要的金属元素。下列说法正确的是
A.三者对应的氧化物均为碱性氧化物
B.三者的单质放置在空气中均只生成氧化物
C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
D.电解AlCl3、FeCl3、CuCl2的混合溶液时,阴极上依次析出Cu、Fe、Al
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省盐城市高三第二次调研考试化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W的原子序数依次增大,X是形成化合物最多的元素,且X常见化合价为+1和-1,Y原子最外层电子数是次外层的3倍;Z与X处于同一主族,W的原子序数是Y的2倍。下列叙述不正确的是
A.原子半径的大小顺序:r(Z)>r(W)>r(Y)>r(X)
B.元素Y的简单气态氢化物的热稳定性比W的弱
C.化合物Z2Y2与X2Y反应时,Z2Y2既是氧化剂又是还原剂
D.由X、Y、Z、W四种元素组成的化合物其水溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省无锡市高三期中化学试卷(解析版) 题型:选择题
一定条件下进行反应:COCl2(g) Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法正确的是
A.保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol·L-1,则反应的ΔH<0
B.若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变
C.保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,反应达到平衡前的速率:v(正)<v(逆)
D.保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60%
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省无锡市高三期中化学试卷(解析版) 题型:选择题
下列物质的转化在给定条件下能实现的是
①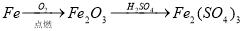
②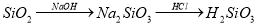
③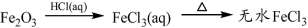
④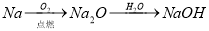
⑤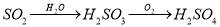
A.①⑤ B.②⑤ C.③④ D.②③
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省宿迁市高三上学期第一次摸底考试化学试卷(解析版) 题型:实验题
(15分)硫酸工业产生的废气A(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境。某化学兴趣小组对废气A的组成进行探究,请回答下列问题。
(1)同学甲设计实验检验废气A中含有的CO2,应选择的试剂有 。
A.NaOH溶液 B.酸性KMnO4溶液 C.澄清石灰水 D.盐酸
(2)同学乙欲测定废气A中SO2的含量,取a L废气A并设计了如下装置进行实验。
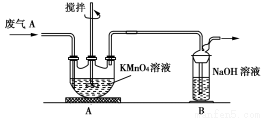
①为了保证实验成功,装置A应具有的现象是 ,搅拌的目的是 。
②同学丙认为A装置前后的质量差就是a L废气中含有的SO2的质量,然后进行含量计算。经小组讨论后,同学丁提出疑问,按照同学丙的实验,若废气中SO2完全被吸收,则最后测定的结果应该偏大,同学丁推断的理由是 。
(3)兴趣小组的同学查阅资料发现可利用硫酸工业废气A制备皓矾(ZnSO4?7H2O)。实验模拟制备皓矾工业流程如下:

①“氧化”中加入硫酸铁发生反应的离子方程式是 。
②加入Zn粉的目的是 。
③固体A主要成分是 。
④操作b得到纯净皓矾晶体,必要的操作是 、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省宿迁市高三上学期第一次摸底考试化学试卷(解析版) 题型:选择题
某有机物X的结构简式如下图所示,则下列有关说法中正确的是

A.有机物X的分子式为C12H15O3
B.X分子中含有1个手性碳原子
C.X在一定条件下能发生加成、取代、消去等反应
D.在Ni作催化剂的条件下,1 mol X最多能与4 mol H2加成
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省连云港市高三上学期期中化学试卷(解析版) 题型:填空题
(10分)a、b、c、d、e是含有一种相同元素的五种物质,可发生如下转化:

其中:a是单质;b是气体;c、d是氧化物;e是最高价氧化物对应的水化物。
(1)如果a是一种淡黄色粉末固体,试推断:(用化学式表示):
a ;b ; e 。写出由c生成d的化学方程式__ ___
(2)如果a为单质且是一种常见气体,试推断这五种物质(用化学式表示):
a ;b ;c ;并写出由d生成e的化学方程式_____ _______
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆复旦中学高二上学期期中化学试卷(解析版) 题型:填空题
(15分)含氮化合物对人类生活有十分重大的意义。
(1)目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合。
已知:N2(g)+O2(g) =2NO(g) △H=+180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905kJ/mol
2H2(g)+ O2(g)=2H2O(g) △H=-483.6kJ/mol
①写出工业合成氨的热化学方程式: 。
②实验室模拟合成氨,在2L密闭容器中投入1molN2 和3mol H2,容器中氨气的体积分数随时间变化如图所示。则0~10min,NH3的平均速率为 ;达平衡时,N2的转化率为 。

③若在②达平衡后,保持容器体积及温度不变,移走0.5molNH3,再达平衡时,N2的体积分数将 ,平衡常数 (填“增大”“减小”或“不变”)
(2)科学家一直致力于研究常温常压下“人工固氮”的方法。据报道:在常温常压条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水反应,生成NH3和一种单质。进一步研究NH3生成量与温度关系,部分实验数据如下(反应时间3h,其余条件一样)
T/℃ | 30 | 40 | 50 |
NH3生成量/10-6mol | 4.8 | 5.9 | 6.0 |
①写出常温下“人工固氮”反应的化学方程式: _此反应△H 0(填“>”、“<”或“=)。
②该反应中的催化剂TiO2的制取方法之一是将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解。写出TiCl4水解的化学方程式: 。
③在上述固氮过程中,除加入催化剂外,能提高生产速率,但不降低产率的措施还可以是 。
A.适当升高温度 B.将氨气液化分离
C.增大反应物N2的浓度 D.增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com