
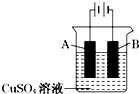
 钢铁工业是国家工业的支柱,每年钢铁生锈让国家损失大量资金,请回答钢铁腐蚀与防护过程中的有关问题.
钢铁工业是国家工业的支柱,每年钢铁生锈让国家损失大量资金,请回答钢铁腐蚀与防护过程中的有关问题.分析 ①电镀时,镀层作阳极,镀件作阴极,阴极上得电子发生还原反应;
②阳极上铜失电子发生氧化反应,阴极上铜离子得电子发生还原反应,若电镀前铁、铜两片金属质量相同,电镀完成后二者质量差为5.12g,二者质量差的一半为阴极析出的铜,根据铜和转移电子之间的关系式计算;
③作原电池负极的铁易被腐蚀,作原电池正极的铁被保护.
解答 解:①电镀时,镀层铜作阳极,镀件铁作阴极,所以A是铜,B是铁,阴极上铜离子得电子生成铜,电极反应式为Cu2++2e-═Cu,
故答案为:铜;Cu2++2e-═Cu;
②阳极上铜失电子发生氧化反应,阴极上铜离子得电子发生还原反应,若电镀前铁、铜两片金属质量相同,电镀完成后二者质量差为5.12g,二者质量差的一半为阴极析出的铜,则转移电子的物质的量=$\frac{\frac{5.12g}{2}}{64g/mol}$=0.08mol,
故答案为:0.08;
③锌、铁和电解质溶液构成原电池时,锌易失电子作负极,铁作正极被保护,铜、铁和电解质溶液构成原电池时,铁易失电子作负极被腐蚀,所以镀铜铁比镀锌铁更容易被腐蚀,
故答案为:铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀.
点评 本题考查了金属的腐蚀与防护,明确原电池和电解池原理是解本题关键,知道作原电池负极和电解池阳极的金属易被腐蚀,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1 mol NO与0.5 mol O2混合后气体的体积为22.4 L | |
| B. | 1L 0.5 mol•L-1 NaF溶液中含有的F-数目为0.5NA | |
| C. | 7.8g Na2S和Na2O2晶体混合物中共含有0.1NA个阴离子 | |
| D. | 12g石墨晶体中正六边形的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性高锰酸钾溶液、石蕊试液褪色 | |
| B. | 能使品红溶液褪色的不一定是SO2 | |
| C. | SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同 | |
| D. | SO2和Cl2等物质的量混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向 AlCl3溶液中滴加浓氨水至过量:Al3++4OH-═AlO2-+2H2O | |
| B. | 漂白粉溶液中通入过量SO2:ClOˉ+H2O+SO2═HSO3-+HClO | |
| C. | CuSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-═BaSO4↓ | |
| D. | 在澄清石灰水中加入少量小苏打溶液:Ca2++OHˉ+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种一元弱酸HX、HY、HZ,其电离平衡常数依次减小,则同体积同pH的对应钠盐溶液中,水的电离度大小是NaX>NaY>NaZ | |
| B. | 0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)=c( H+)+c(CH3COOH) | |
| C. | 0.1mol/LNaHS溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c( S2-)>c(HS-)>c(OH-) | |
| D. | 向0.01mol/L的NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)=c( SO42-)>c(NH4+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入反应物,使活化分子的百分数增加,反应速率加快 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小体积)可增加活化分子的百分数使化学反应速率增大 | |
| C. | 升高温度使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 活化分子间发生的碰撞为有效碰撞 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com