
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| 4.0×10-38 |
| (10-9)3 |
| 4.0×10-38 |
| (10-9)3 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省南通市海安县高一上学期期末考试化学试卷(带解析) 题型:实验题
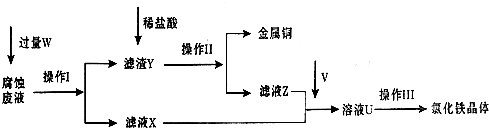
(12分)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
试回答下列问题:
⑴FeCl3蚀刻铜箔反应生成FeCl2和CuCl2的离子方程式为 ;
证明蚀刻后的混合物溶液仍存在Fe3+的操作是:
。
⑵过程I加入铁屑的主要作用是_______ ;从固体中分离出铜需采用的方法是_________ 。
⑶过程II中发生主要反应的化学方程式为:_____ , 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第9讲 金属及其化合物练习卷(解析版) 题型:填空题
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
Ⅰ:向废液中投入过量铁屑,充分反应后分离出固体和滤液;
Ⅱ:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
已知:Ksp[Fe(OH)3]=4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为________________________________________;
(2)过程Ⅰ加入铁屑的主要作用是__________________,分离得到固体的主要成分是________,从固体中分离出铜需采用的方法是___________________________________;
(3)过程Ⅱ中发生反应的化学方程式为________________________________;
(4)过程Ⅱ中调节溶液的pH为5,金属离子浓度为__________________________。(列式计算)
查看答案和解析>>
科目:高中化学 来源:2015届江苏省南通市海安县高一上学期期末考试化学试卷(解析版) 题型:实验题
(12分)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
试回答下列问题:
⑴FeCl3蚀刻铜箔反应生成FeCl2和CuCl2的离子方程式为 ;
证明蚀刻后的混合物溶液仍存在Fe3+的操作是:
。
⑵过程I加入铁屑的主要作用是_______ ;从固体中分离出铜需采用的方法是_________ 。
⑶过程II中发生主要反应的化学方程式为:_____ , 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com